
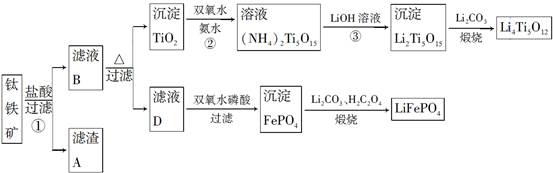
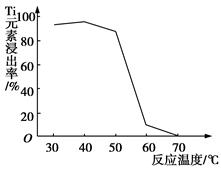
 Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。
Li7Ti5O12+3FePO4,该电池充电时阳极反应式是____________________。 TiO2↓+2H++4Cl-
TiO2↓+2H++4Cl- :90=20:9。(7)该电池充电时阳极上LiFePO4发生氧化反应。
:90=20:9。(7)该电池充电时阳极上LiFePO4发生氧化反应。

科目:高中化学 来源:不详 题型:单选题
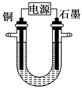
| A.黑色粉末X是铁粉 |
| B.铜电极连接电源正极 |
| C.石墨电极上发生的反应是4OH--4e-=O2↑+2H2O |
D.铜的相对原子质量的计算式是 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
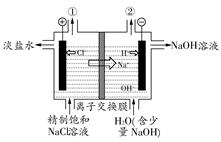
| A.装置中出口①处的物质是氯气,出口②处的物质是氢气 |
| B.该离子交换膜只能让阳离子通过,不能让阴离子通过 |
C.装置中发生反应的离子方程式为:2Cl-+2H+ Cl2↑+H2↑ Cl2↑+H2↑ |
| D.该装置是将电能转化为化学能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
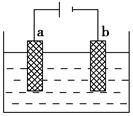
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
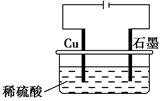
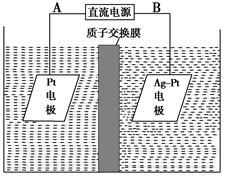
| A.电解过程中,铜电极上有H2产生 |
B.电解初期,主反应方程式为Cu+H2SO4 CuSO4+H2↑ CuSO4+H2↑ |
| C.电解一定时间后,石墨电极上有铜析出 |
| D.整个电解过程中,H+的浓度不断增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
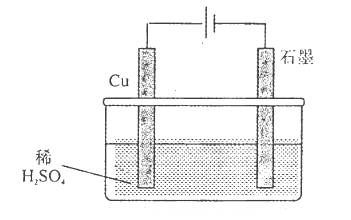
| A.电解初期,石墨电极上有H2产生 |
| B.整个电解过程中,H+的浓度不断增大 |
| C.电解一定时间后,石墨电极上有铜析出 |
D.电解初期,总反应方程式为: |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
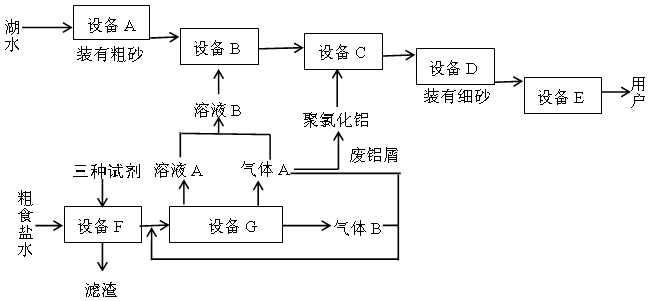

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
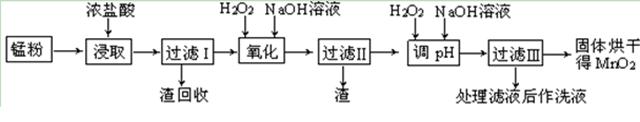
| 物 质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
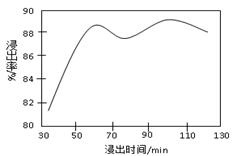
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com