
| A. | 放电时负极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 放电时每转移3mol电子,正极有1 mol K2FeO4被还原 | |
| C. | 充电时阴极附近溶液的碱性增强 | |
| D. | 放电时正极反应式为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
分析 根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,高铁酸钠在正极得到电子,电极反应式为FeO42+4H2O+3e-=Fe(OH)3+5OH-,根据电极反应式可判断电子转移的物质的量与反应物之间的关系,充电时,阳极上氢氧化铁转化成高铁酸钠,电极反应式为Fe(OH)3+5OH-=FeO42+4H2O+3e-,阳极消耗OH-离子,碱性要减弱,以此解答该题.
解答 解:A.根据电池的总反应可知,高铁电池放电时必定是锌在负极失去电子,电极反应式为Zn-2e-+2OH-=Zn(OH)2,故A正确;
B.放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,每转移3mol电子,正极有1molK2FeO4被还原,故B正确;
C.充电时阴极发生Zn(OH)2=Zn-2e-+2OH-,碱性增强,故C正确;
D.放电时正极反应为FeO42+4H2O+3e-=Fe(OH)3+5OH-,故D错误.
故选D.
点评 本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,增加了学生分析问题的思维跨度,强调了学生整合知识的能力.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
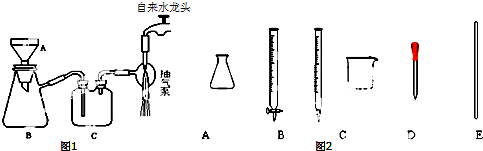
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
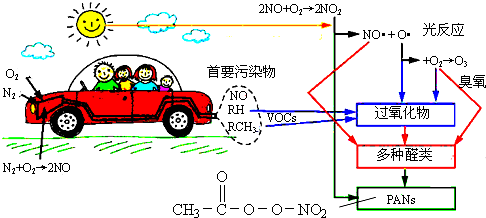
| A. | 汽车尾气中的NO、碳氢化合物(图中RH和RCH3)均来自燃油 | |
| B. | 醛类、PANs(过氧乙酰硝酸酯)均属于无机物 | |
| C. | O3污染、硝酸型酸雨及雾霾均与汽车尾气排放无关 | |
| D. | 汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因之一是N2与O2的反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠固体 | B. | 硫酸铜固体 | C. | 氯化钠溶液 | D. | 硝酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖的分子式是C6H12O6 | B. | 葡萄糖属于有机高分子化合物 | ||
| C. | 葡萄糖是人体重要的能量来源 | D. | 葡萄糖能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用高纯硅可以制成光电池,将光能直接转化为电能 | |
| B. | CO、CO2均易于血红蛋白结合而中毒 | |
| C. | SiO2可用于制造光导纤维和半导体 | |
| D. | SiO2和H2O反应可直接制备H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
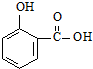 )的沸点与对羟基苯甲酸(
)的沸点与对羟基苯甲酸(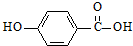 )的沸点相同是由于它们互为同分异构体不正确;邻羟基苯甲醛分子内的羟基与醛基之间即存在氢键(分子内氢键),而对羟基苯甲醛分子之间存在氢键(分子间氢键),与互为同分异构体无关.
)的沸点相同是由于它们互为同分异构体不正确;邻羟基苯甲醛分子内的羟基与醛基之间即存在氢键(分子内氢键),而对羟基苯甲醛分子之间存在氢键(分子间氢键),与互为同分异构体无关.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com