
| A. | 碳酸氢钠的水解:HCO3-+H2O=H3+O+CO32- | |
| B. | 14g乙烯燃烧生成液态水产生b kJ热量,则表示其燃烧热的热化学方程式为:C2H4(g)+3O2(g)═2H2O(g)+2CO2(g)△H=-2b kJ•mol-1 | |
| C. | 用两根铜棒电解盐酸:2H++2Cl-$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑ | |
| D. | 在酸性碘化亚铁溶液中通入少量氧气:4I-+O2+4H+=2I2+2H2O |
分析 A.碳酸氢钠水解生成碳酸和氢氧化钠;
B.燃烧热,应生成稳定的氧化物;
C.阳极上铜失电子、阴极上氢离子得电子;
D.二者发生氧化还原反应生成碘和水.
解答 解:A.碳酸氢钠的水解,离子方程式:HCO3-+H2O?OH-+H2CO3,故A错误;
B.依据燃烧热概念,乙烯燃烧生成液态水稳定,故B错误;
C.阳极上铜失电子、阴极上氢离子得电子,离子方程式为2H++Cu$\frac{\underline{\;通电\;}}{\;}$H2↑+Cu2+,故C错误;
D.在酸性碘化亚铁溶液中通入少量氧气,离子方程式为4I-+O2+4H+=2I2+2H2O,故D正确;
故选:D.
点评 本题考查离子方程式的书写,为高考高频点,明确物质性质及离子方程式书写规则是解本题关键,注意D中离子反应先后顺序,注意燃烧热概念,题目难度不大.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:实验题
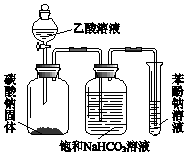 某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.
某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷和红磷互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以${\;}_{2}^{4}$He具有较强的金属性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 严格控制硝酸厂的尾气处理 | |
| B. | 倡导使用无磷洗衣粉 | |
| C. | 研究新型催化剂,消除汽车尾气污染 | |
| D. | 禁止使用含氟电冰箱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③②①⑤④ | B. | ②①③⑤④ | C. | ③①②⑤④ | D. | ②③①⑤④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg $?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )
一种高能纳米级Fe3S4和镁的二次电池,其工作原理为:Fe3S4+4Mg $?_{充电}^{放电}$3Fe+4MgS,装置如图所示.下列说法不正确的是( )| A. | 放电时,镁电极为负极,发生氧化反应 | |
| B. | 放电时,正极的电极反应式为Fe3S4+8e-=3Fe+4S2- | |
| C. | 充电时,S2-从阴离子交换膜左侧向右侧迁移 | |
| D. | 充电时转移2mol电子,阴极质量减少32g |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
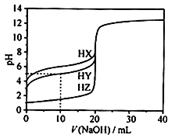 25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )
25℃时,用0.1000mol•L-1的NaOH溶液分别滴定20.00mL均为0.1000mol•L-1的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法错误的是( )| A. | HZ是强酸,HX、HY是弱酸 | |
| B. | 根据滴定曲线,可得Ka(HY)≈10-5 | |
| C. | 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)=c(Z-)+c(Y-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com