
(10分)已知反应:CO(g) + H2O(g)![]() CO2 (g) + H2(g)
CO2 (g) + H2(g)
(1)将1molCO和1mol H2O(g)充入某固定容积的反应器,在某温度下达到平衡:此时有2/3的CO转化为CO2。则该反应平衡常数的表达式为___ ___,此温度下平衡常数为 。
(2)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2,则达到平衡时与(1)相比较,
平衡应 移动(填“向正反应方向”、“向逆反应方向”或“不”),此时平衡混合气中CO2的体积分数约是下列各值中的 (填编号)
A. 22.2% B.27.55% C.33.3% D.36.8%
(3)若在相同条件下,向该容器中充入1 mol CO2、1 mol H2和1mol H2O(g),则达到平衡时与(1)相比较,则下列说法中正确的是 (填序号)
①生成物的产量一定增加 ②反应物的浓度一定降低
③反应物的转化率一定增加 ④CO在平衡混合气中的百分含量一定降低
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
(8分)已知反应:CO(g) + H2O(g)H2(g) + CO2(g) ΔH= Q kJ·mol-1,其平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述可逆反应中Q 0(填“大于”或“小于”)。
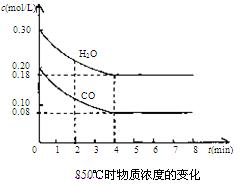
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图。试回答:
①0~4 min的平均反应速率v(CO)=______ mol/(L·min)
②下列表述能作为该可逆反应达到平衡标志的是__________(填序号)。
A.当混合气体的密度保持不变时
B.当反应消耗0.1molCO(g)同时也生成0.1molH2O(g)时
C.当CO(g)的质量分数保持不变时
D.当该反应的ΔH不变时
(3)若要加快该反应速率,同时还要提高CO的转化率,可采取的措施为_____(填序号)。
A.增加水蒸气的量 B.降低温度
C.使用催化剂 D.增大压强 E.不断移走CO2
查看答案和解析>>
科目:高中化学 来源:2011届海南省海口市高三高考调研测试地化学试卷 题型:填空题
(8分)已知反应:CO(g) + H2O(g) H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.9 4 4 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第6讲 化学反应速率和化学平衡练习卷(解析版) 题型:选择题
已知反应①:CO(g)+CuO(s)??CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)  Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=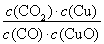
B.反应③的平衡常数K=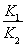
C.对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源:2015届河南省漯河市高二上学期期中考试化学试卷(解析版) 题型:计算题
已知反应:CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
在427°C时的平衡常数是9.4.如果反应开始时,一氧化碳和水蒸气的浓度都是0.01mol·L-1,计算一氧化碳在此反应条件下的转化率。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年海南省海口市高三高考调研测试地化学试卷 题型:填空题
(8分)已知反应:CO(g) + H2O(g) H2(g) + CO2(g) ΔH= Q kJ·mol-1,其平衡常数随温度的变化如下表:
|
温度/℃ |
400 |
500 |
850 |
|
平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述可逆反应中Q 0(填“大于”或“小于”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图。试回答:
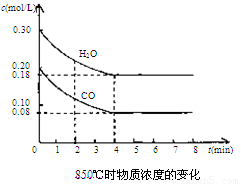
①0~4 min的平均反应速率v(CO)=______ mol/(L·min)
②下列表述能作为该可逆反应达到平衡标志的是__________(填序号)。
A.当混合气体的密度保持不变时
B.当反应消耗0.1molCO(g) 同时也生成0.1molH2O(g)时
C.当CO(g)的质量分数保持不变时
D.当该反应的ΔH不变时
(3)若要加快该反应速率,同时还要提高CO的转化率,可采取的措施为_____(填序号)。
A.增加水蒸气的量 B.降低温度
C.使用催化剂 D.增大压强 E.不断移走CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com