
| A. | 食用油属于有机物,石蜡属于无机物 | |
| B. | 食用油属于纯净物,石蜡属于混合物 | |
| C. | 食用油属于酯类物质,石蜡属于烃类 | |
| D. | 食用油属于高分子化合物,石蜡属于小分子化合物 |
分析 A.根据含有碳元素的化合物叫有机化合物,简称有机物;碳的氧化物、碳酸盐、碳酸、氰化物,氰酸盐虽含碳虽含碳,但其性质与无机物类似,因此把它们看作无机物;
B.天然油脂是混合物;
C.食用油是高级脂肪酸与甘油形成的酯;
D.相对分子质量在10000以上的有机化合物为高分子化合物.
解答 解:A.食用油和石蜡油属于有机物,故A错误;
B.天然油脂和石蜡是混合物,故B错误;
C.食用油是高级脂肪酸与甘油形成的酯,石蜡油属于烃类,故C正确;
D.食用油的成分是油脂,油脂相对分子质量较小,不属于高分子化合物,故D错误.
故选C.
点评 本题考查物质的分类,难度不大,掌握概念的内容是解题的关键.


 全优测试卷系列答案
全优测试卷系列答案 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 4个 | B. | 5个 | C. | 6个 | D. | 7个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
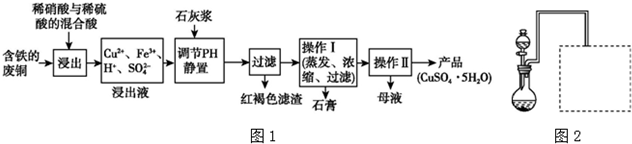
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
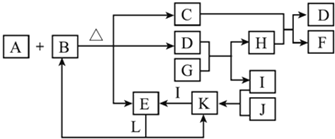
 A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:
A、B、C、D、E五种物质(或离子)均含有同一种元素,它们之间有如图所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
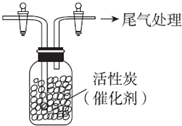 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化碳具有漂白性 |
| B | 向2mL1mol•L-1NaOH溶液中先加入3滴1mol•L-1FeCl3溶液,再加入3滴1mol•L-1MgCl2溶液 | 证明Ksp[Mg(OH)2]>ksp[Fe(OH)3] |
| C | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴含NaClO的“84”消毒液,观察红色褪色的快慢 | 证明随着溶液pH的减小,“84”消毒液的氧化能力增强 |
| D | 相同温度下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com