
 铬及其化合物在工业上用重要用途,请回答下列问题:
铬及其化合物在工业上用重要用途,请回答下列问题:| m |
| V |
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| 4×(52+14) |
| 6.02×1023 |
| 4×(52+14) |
| 6.02×1023×8a3×10-30 |
| 4×(52+14) |
| 6.02×1023×8a3×10-30 |


科目:高中化学 来源: 题型:
| A、C3H8 |
| B、C4H6 |
| C、C3H6 |
| D、C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
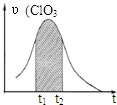 KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )
KClO3和KHSO3能发生反应:ClO3-+HSO3-→SO42-+Cl-+H+(未配平).已知该反应的速率随c(H+)的增大而加快.图为用ClO3-在单位时间内物质的量浓度变化表示的该反应υ-t图.下列说法正确的( )| A、反应开始时速率增大可能是c(H+)所致 |
| B、纵坐标为υ(Cl-)的υ-t曲线与图中曲线不能完全重合 |
| C、后期速率υ下降的主要原因是反应向逆反应方向进行 |
| D、图中阴影“面积”可以表示t1-t2时间内c(Cl-)增加量 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com