
 常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的氢氧化钠溶液,整个过程中pH( )
常温下,将Cl2缓慢通入一定量的水中至饱和,然后向所得饱和氯水中逐滴加入0.1mol?L-1的氢氧化钠溶液,整个过程中pH( )| A、①点所示溶液中:c(H+)=c(Cl-)+c(ClO-) |
| B、②点所示溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO) |
| C、③点所示溶液中:c(Na+)=c(HClO)+2c(ClO-) |
| D、④点所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO) |


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| A、1 mol任何气体的体积都约是22.4 L |
| B、标准状况时,氧气的体积约是22.4 L |
| C、1 molH2和1 molH2O在标准状况下体积都约是22.4 L |
| D、1 mol任何气体在标准状况下所占体积都约是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
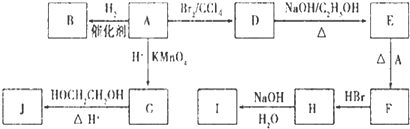
查看答案和解析>>
科目:高中化学 来源: 题型:
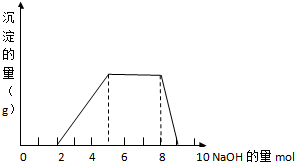 某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)
某溶液中可能含有H+,NH4+,Mg2+,Fe3+,Cl-,Al3+,SO42-等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随加入的溶液中NaOH的物质的量的变化如图所示:(已知:Fe3++3OH-=Fe(OH)3,且Fe(OH)3难溶于水;NH4++OH-=NH3?H2O)查看答案和解析>>
科目:高中化学 来源: 题型:
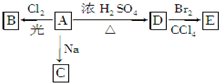 化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:
化合物A(C4H10O)是一种有机溶剂.A可以发生如下变化:查看答案和解析>>
科目:高中化学 来源: 题型:
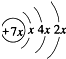 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | C | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、1个 | B、2个 | C、3个 | D、4个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com