
(1�֣�W��X��Y��Z��L��MΪԪ�����ڱ���ԭ��������������Ķ�����Ԫ�ء�
��֪����X�ĵ�����Z2��ȼ�տ�����XZ��XZ2�������壻
��L��һ�ֽ�м���ʣ��ý�����Z2��Ӧ������L2Z��L2Z2���ֹ��壻
��M�ĵ�����Z2��ȼ�յIJ����ʹƷ����Һ��ɫ�����Ⱥ�ָ�ԭɫ��
��ش��������⣺
(1) д��L2Z�ĵ���ʽ________
(2) д��L2Z2��XZ2���巴Ӧ�Ļ�ѧ����ʽ________________________________
(3) X��Y��Z�ֱ���W���γ�10���ӻ���������ֻ������зе����{���ǣ��ѧʽ��________________, W��Y��Z���γ����ӻ�����W4Y2Z3,��ˮ��Һ�и�����Ũ���ɴ�С��˳��Ϊ________________________, W2Z2��FeSO4�������ϡ�����У���Ӧ�����ӷ���ʽΪ________________________________________��
(4) ���ݻ�Ϊ2L���ܱ������м���0.48mol MZ2��0.22mol Z2, �����¶��·�Ӧ�ﵽƽ��ʱ�õ�0. 24 mol MZ3,��Ӧ�Ļ�ѧƽ�ⳣ��K=________�����¶Ȳ��䣬�ټ���0.50 mol Z2�����´ﵽƽ�⣬��Z2��ת����________ (����ߡ��������䡱���͡�)��MZ3���������________ (����������䡱��С��)��
(1)  ��(2) 2Na2O2+2CO2=2Na2CO3+O2��(3) H2O��c(NO3-)>c(NH4+)>c(H+)>c(OH-)��H2O2 +2Fe2++ 2H+=2Fe3++2H2O��(4) 20�����ͣ���С��
��(2) 2Na2O2+2CO2=2Na2CO3+O2��(3) H2O��c(NO3-)>c(NH4+)>c(H+)>c(OH-)��H2O2 +2Fe2++ 2H+=2Fe3++2H2O��(4) 20�����ͣ���С��
��������������Ԫ���ƶ��⣬����ѧ����֪ʶ��Ӧ�ú��ƶ�����������Ĺؼ����Ƴ�����Ԫ�ء��ɡ�X�ĵ�����Z2��ȼ�տ�����XZ��XZ2�������塱�����Ƴ���X��̼Ԫ�ء�Z����Ԫ�أ��ɡ�L��һ�ֽ�м���ʣ��ý�����Z2��Ӧ������L2Z��L2Z2���ֹ��塱 �����Ƴ���L����Ԫ�أ��ɡ�M�ĵ�����Z2��ȼ�յIJ����ʹƷ����Һ��ɫ�����Ⱥ�ָ�ԭɫ�� �����Ƴ���M����Ԫ�ء�(1) L2Z��Na2O������ʽΪ ��(2) Na2O2��CO2��Ӧ�ķ���ʽ��2Na2O2+2CO2=2Na2CO3+O2��(3)����X��Y��Z�ֱ�����W���γ�10���ӻ����Y��ԭ����������C��O����WΪH��YΪN���⻯��ֱ���CH4��NH3��H2O�����ں����߷��Ӽ���γ������CH4���Ӽ䲻���γ�����������ֻ������зе����{����H2O��W��Y��Z���γ����ӻ�����W4Y2Z3��NH4NO3����һ��ǿ�������Σ�NH4+��ˮ�з���ˮ�⣬��Һ�����ԣ�NH4+����Ũ�ȼ�С��ˮ��Һ�и�����Ũ���ɴ�С��˳��Ϊc(NO3-)>c(NH4+)>c(H+)>c(OH-)��H2O2���������ԣ��ܽ�Fe2+����ΪFe3+�����ӷ���ʽΪH2O2 +2Fe2++ 2H+=2Fe3++2H2O��(4) 0.48molSO2��0.22molO2��2L�ܱ������з�Ӧ�ﵽƽ��õ�0.24 mol SO3��ƽ��ʱSO2��O2��SO3��Ũ�ȷֱ�Ϊ0.12mol/L��0.05mol/L��0.12mol/L����÷�Ӧ��ƽ�ⳣ��Ϊ(0.12mol/L)2/[(0.12mol/L)2��0.05mol/L]=20��SO3���������Ϊ0.12/(0.12+0.12+0.05)=0.41��O2ת����Ϊ0.06/0.11=6/11�����¶Ȳ��䣬�ټ���0.50 mol O2�����´ﵽƽ�⣬O2��ת���ʽ��ͣ�ƽ�������ƶ���
��(2) Na2O2��CO2��Ӧ�ķ���ʽ��2Na2O2+2CO2=2Na2CO3+O2��(3)����X��Y��Z�ֱ�����W���γ�10���ӻ����Y��ԭ����������C��O����WΪH��YΪN���⻯��ֱ���CH4��NH3��H2O�����ں����߷��Ӽ���γ������CH4���Ӽ䲻���γ�����������ֻ������зе����{����H2O��W��Y��Z���γ����ӻ�����W4Y2Z3��NH4NO3����һ��ǿ�������Σ�NH4+��ˮ�з���ˮ�⣬��Һ�����ԣ�NH4+����Ũ�ȼ�С��ˮ��Һ�и�����Ũ���ɴ�С��˳��Ϊc(NO3-)>c(NH4+)>c(H+)>c(OH-)��H2O2���������ԣ��ܽ�Fe2+����ΪFe3+�����ӷ���ʽΪH2O2 +2Fe2++ 2H+=2Fe3++2H2O��(4) 0.48molSO2��0.22molO2��2L�ܱ������з�Ӧ�ﵽƽ��õ�0.24 mol SO3��ƽ��ʱSO2��O2��SO3��Ũ�ȷֱ�Ϊ0.12mol/L��0.05mol/L��0.12mol/L����÷�Ӧ��ƽ�ⳣ��Ϊ(0.12mol/L)2/[(0.12mol/L)2��0.05mol/L]=20��SO3���������Ϊ0.12/(0.12+0.12+0.05)=0.41��O2ת����Ϊ0.06/0.11=6/11�����¶Ȳ��䣬�ټ���0.50 mol O2�����´ﵽƽ�⣬O2��ת���ʽ��ͣ�ƽ�������ƶ���
2SO2+ O2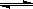 2SO3
2SO3
ʼ �� 0.12 0.3 0.12
�� �� 2x x 2x
ƽ����0.12-2x 0.3-x 0.12+2x������(0.12-2x)2/[(0.12+2x)2��(0.3-x)]=20�����x��0.025��SO3���������Ϊ0.17/(0.24+0.275)=0.33����0.41С����SO3�����������С����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(1�֣�W��X��Y��Z��L��MΪԪ�����ڱ���ԭ��������������Ķ�����Ԫ�ء�
��֪����X�ĵ�����Z2��ȼ�տ�����XZ��XZ2�������壻
��L��һ�ֽ�м���ʣ��ý�����Z2��Ӧ������L2Z��L2Z2���ֹ��壻
��M�ĵ�����Z2��ȼ�յIJ����ʹƷ����Һ��ɫ�����Ⱥ�ָ�ԭɫ��
��ش��������⣺
(1) д��L2Z�ĵ���ʽ________
(2) д��L2Z2��XZ2���巴Ӧ�Ļ�ѧ����ʽ________________________________
(3) X��Y��Z�ֱ���W���γ�10���ӻ���������ֻ������зе����{���ǣ��ѧʽ��________________, W��Y��Z���γ����ӻ�����W4Y2Z3,��ˮ��Һ�и�����Ũ���ɴ�С��˳��Ϊ________________________, W2Z2��FeSO4�������ϡ�����У���Ӧ�����ӷ���ʽΪ________________________________________��
(4) ���ݻ�Ϊ2L���ܱ������м���0.48molMZ2��0.22mol Z2,�����¶��·�Ӧ�ﵽƽ��ʱ�õ�0. 24 mol MZ3,��Ӧ�Ļ�ѧƽ�ⳣ��K=________�����¶Ȳ��䣬�ټ���0.50 mol Z2�����´ﵽƽ�⣬��Z2��ת����________ (����ߡ��������䡱���͡�)��MZ3���������________ (����������䡱��С��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
(5��) ��W��X��Y��Z���ֶ�����Ԫ�أ����ǵĺ˵������������ WԪ��ԭ��������ԭ���а뾶��С�ģ� XԪ��ԭ��L���������K���������3��, YԪ��ԭ�ӵ���������������Ӳ�����ͬ��ZԪ��ԭ�ӵ������������ȴ������1���ɴ˿�֪��
(1)д�����ǵ�Ԫ�ط���W_______X______Y_______Z________.
��2��X��Ԫ�����ڱ��е�λ���� _________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012��ӱ�ʡ�����и�����ѧ����ĩ���п��������ۺϻ�ѧ�Ծ��������棩 ���ͣ������
(1�֣�W��X��Y��Z��L��MΪԪ�����ڱ���ԭ��������������Ķ�����Ԫ�ء�
��֪����X�ĵ�����Z2��ȼ�տ�����XZ��XZ2�������壻
��L��һ�ֽ�м���ʣ��ý�����Z2��Ӧ������L2Z��L2Z2���ֹ��壻
��M�ĵ�����Z2��ȼ�յIJ����ʹƷ����Һ��ɫ�����Ⱥ�ָ�ԭɫ��
��ش��������⣺
(1) д��L2Z�ĵ���ʽ________
(2) д��L2Z2��XZ2���巴Ӧ�Ļ�ѧ����ʽ________________________________
(3) X��Y��Z�ֱ���W���γ�10���ӻ���������ֻ������зе����{���ǣ��ѧʽ��________________, W��Y��Z���γ����ӻ�����W4Y2Z3,��ˮ��Һ�и�����Ũ���ɴ�С��˳��Ϊ________________________, W2Z2��FeSO4�������ϡ�����У���Ӧ�����ӷ���ʽΪ________________________________________��
(4) ���ݻ�Ϊ2L���ܱ������м���0.48mol MZ2��0.22mol Z2, �����¶��·�Ӧ�ﵽƽ��ʱ�õ�0. 24 mol MZ3,��Ӧ�Ļ�ѧƽ�ⳣ��K=________�����¶Ȳ��䣬�ټ���0.50 mol Z2�����´ﵽƽ�⣬��Z2��ת����________ (����ߡ��������䡱���͡�)��MZ3���������________ (����������䡱��С��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��㶫��������ѧ��һ�ڶ�ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
(5��) ��W��X��Y��Z���ֶ�����Ԫ�أ����ǵĺ˵������������ WԪ��ԭ��������ԭ���а뾶��С�ģ� XԪ��ԭ��L���������K���������3��, YԪ��ԭ�ӵ���������������Ӳ�����ͬ��ZԪ��ԭ�ӵ������������ȴ������1���ɴ˿�֪��
(1)д�����ǵ�Ԫ�ط���W_______X______Y_______Z________.
��2��X��Ԫ�����ڱ��е�λ���� _________ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com