
(12分,每空2分)(Ⅰ)写出下列物质在水溶液中的电离方程式:
NaHSO4 , K2SO4 ,
NH4NO3 , Al2(SO4)3 ___________________________________。
(Ⅱ)将下列离子反应,改写成对应的化学方程式:
(1)Cu + 2Ag+ = Cu2++ 2Ag;___________________________________
(2) CaCO3 + 2H+ = CO2↑+ H2O +Ca2+;_______________ ________________
________________
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源:2012-2013学年山西省大同市实验中学高一第一次月考化学试卷(带解析) 题型:填空题
(12分,每空2分)现有含NaCl、Na2SO4和NaNO3的混合物,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-、和NO3-的相互分离。相应的实验过程可用下图表示: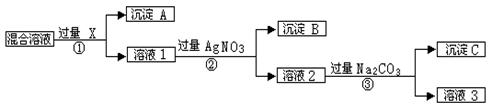 请回答下列问题:
请回答下列问题:
[1]写出实验流程中下列物质的化学式
试剂X : 沉淀A: 沉淀B:
[2]上述实验流程中加入过量的Na2CO3的目的是 _____ 。
[3]写出③的化学方程式:②________________________________________
[4]按此实验方案得到的溶液3中肯定含有 (填化学式)杂质。
查看答案和解析>>
科目:高中化学 来源:2014届湖北省武汉市高二上学期期中考试化学试卷(解析版) 题型:填空题
(12分,每空2分)一定的条件下,在某一容积为2L的密闭容器内,物质A、B、C发生某种放热化学反应,反应中物质A、B、C的浓度随时间变化情况如图1:

(1)该反应化学方程式为_____________________________________,该反应的逆反应化学平衡常数表达式为___________;
(2)根据图1数据,反应开始至达到平衡时,平均速率v(C)为________________;
(3)反应达到平衡后,第8分钟时:
①若升高温度,C浓度的变化正确________;(用图2中a~f的编号回答)
②若加入B,该反应的平衡常数将____________。(填“增大”或“不变”或“减小”)
(4)反应达到平衡后,第8分钟时,若反应容器的容积扩大一倍,请在图3中用“粗线条”画出8分钟后C浓度的变化情况。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山西省高三8月月考化学试卷(解析版) 题型:填空题
(12分,每空2分)
当今世界,能源的发展日益成为全世界、全人类共同关心的问题。
(1)A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
|
电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
|
A |
899 |
1 757 |
14 840 |
21 000 |
|
B |
738 |
1 451 |
7 733 |
10 540 |
①请根据上述信息,写出A基态原子的核外电子排布式:__________________。
②某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图违背了______________________。
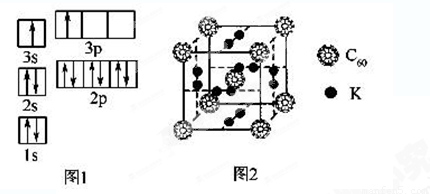
(2)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中C—C键的键长为154.45 pm,C60中C—C键的键长为145 pm和140 pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由____________________________ ________________。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体。该物质中K原子和C60分子的个数比为______________________。
③继C60后,科学家又合成Si60、N60,C、Si、N原子电负性由大到小的顺序是__________ 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为______。
查看答案和解析>>
科目:高中化学 来源:2014届江西省高一上学期第二次月考化学试卷 题型:填空题
(12分,每空2分)(Ⅰ)一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
⑴人体中经常进行Fe2+与Fe3+的转化,可表示为Fe2+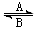 Fe3+。在过程A中,Fe2+作
剂,过程B中,Fe3+作
剂。
Fe3+。在过程A中,Fe2+作
剂,过程B中,Fe3+作
剂。
⑵“服用维生素C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这个反应中作 剂,具有 性。
(Ⅱ)有人在研究硫酸亚铁(FeSO4)受热分解时,作出了两种假设:
(1)假设它按KClO3受热分解的方式分解,反应的化学方程式为 ;
(2)假设它按CaCO3受热分解的方式分解,反应的化学方程式为 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com