
| 化学键 | N≡N | F-F | N-F |
| 键能:kJ/mol | 941.7 | 154.8 | 283.0 |
| A. | 过程F2(g)→2F(g)吸收能量 | |
| B. | 过程N(g)+3F(g)→NF3(g) 放出能量 | |
| C. | 反应N2(g)+3F2(g)=2NF3(g) 放出能量 | |
| D. | NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应 |
分析 化学反应中断裂化学键吸收能量,形成化学键放出能量,反应热等于反应物的总键能减去生成物的总键能,以此解答该题.
解答 解:A.F2(g)→2F(g)为化学键的断裂过程,应吸收能量,故A正确;
B.N(g)+3F(g)→NF3(g)为形成化学键的过程,放出能量,故B正确;
C.反应N2(g)+3F2(g)→2NF3(g)△H=(941.7+3×154.8-283.0×6)KJ•mol-1=-291.9KJ•mol-1,△H<0,放出能量,故C正确;
D.NF3吸收能量后如果没有化学键的断裂与生成,则不能发生化学反应,化学反应的实质是旧键的断裂和新键的形成,故D错误.
故选D.
点评 本题考查了化学反应与能量变化,本题侧重于反应热的考查,题目难度不大,注意化学键的键能与反应热的关系,题目侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:选择题
| A. | CO的生成速率与CO2的生成速率相等 | |
| B. | 气体的密度不再变化 | |
| C. | CO的质量不变 | |
| D. | 体系的压强不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 沸点/℃ | 密度(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
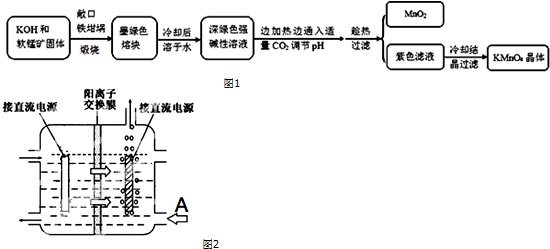
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
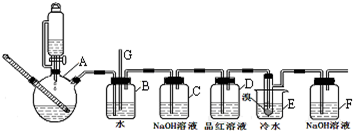
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
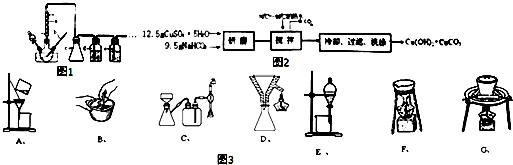
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| C. | SO2的水溶液能够导电,所以SO2是电解质 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com