
(1)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )。
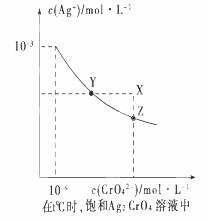
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t ℃时,以0.01 mol/L AgNO3溶液滴定20 mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混和溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
【答案】C
【解析】A、依据图象曲线上的数据结合溶度积常数概念计算得到;曲线上的点是沉淀溶解平衡,Ag2CrO4 的沉淀溶剂平衡为:Ag2CrO4(s)⇌2Ag++CrO42 -,Ksp=c2(Ag+)c(CrO42 -)=(10-3)2×10-6=10-12,错误;B、在饱和Ag2CrO4 溶液中加入K2CrO4 仍为饱和溶液,点仍在曲线上,所以在饱和Ag2CrO4 溶液中加入K2CrO4 不能使溶液由Y点变为X点,错误;C、依据溶度积常数计算Ksp(CrO42 -)= c2(Ag+)c(CrO42 -)=1×10-12;Ksp(AgCl)=c(Ag+)c(Cl-)=1.8×10-10,以0.01 mol/L AgNO3 溶液滴定20 mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,c(CrO42 -)=0.01 mol/L,得到c(Ag+)=10-5mol/L,0.01 mol/L KCl溶液中,c(Cl-)=0.01 mol/L;依据溶度积计算得到:c(Ag+)=2×10−10÷0.01=2×10-8mol/L,所以先析出氯化银沉淀,正确;D、则S(AgCl)=1.41×10-5,而S(Ag2CrO4)=1.1×10-4,所以在t℃时,AgCl的溶解度小于Ag2CrO4,错误,选C。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
某课外小组对日常生活中不可缺少的调味品M进行探究.已知C可在D中燃烧发出苍白色火焰.M与其他物质的转化关系如图1所示(部分产物已略去):
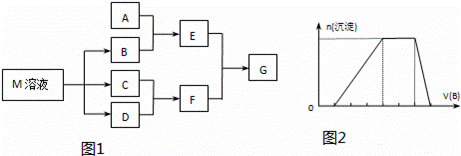
(1)写出用惰性电极电解M溶液的离子方程式 .
(2)写出F的电子式 .
(3)若A是一种常见的酸性氧化物,且可用于制造玻璃,E溶液与F溶液反应可以制备一种胶体,则E溶液的俗称是 .
(4)若A是一种常见金属单质,且A与B溶液能够反应,则将过量的F溶液逐滴加入E溶液,边加边振荡,所看到的实验现象是 .
(5)若A是一种不稳定的盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入苯酚溶液后显紫色,则由A转化成E的离子方程式是 .
(6)若A是一种化肥.实验室可用A和B反应制取气体E,E与F、E与D相遇均冒白烟,且利用E与D的反应检验输送D的管道是否泄露,写出E与D反应的化学方程式是 .
(7)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、CO32﹣、SO42﹣中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生变化如图2所示,由此可知,该溶液中肯定含有的离子及其浓度之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:(1)Zn(s)+1/2O2(g) = ZnO(s)△H =-348.3 kJ/mol
(2)2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H等于
A.-317.3 kJ/mol B.-379.3 kJ/mol C.-332.8 kJ/mol D.+317.3 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:为使Fe3+、Fe2+、Zn2+较完全的形成氢氧化物沉淀,溶液的pH应分别为3.7、9.6、4.4左右。某硫酸锌酸性溶液中含有少量Fe3+、Fe2+,为除去这些离子制得纯净的硫酸锌,应加入的试剂是( )
A. H2O2、ZnO B.氨水 C.KMnO4、ZnCO3 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在372K时,把0.5 mol N2O4通入体积为5 L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为 0.02 mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A. 前2s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B. 在2s时体系内压强为开始时的1.1倍
C. 在平衡时体系内含有N2O4 0.25 mol
D. 平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是( )
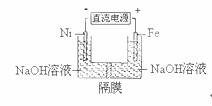
A.铁是阳极,电极反应为Fe-6e-+4H2O=FeO42 -+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH-自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
选择除去下列各组物质中的杂质(括号内物质为杂质)的试剂和方法,填于下表:
| 加入试剂 | 分离方法 | |
| C2H5OH(CH3COOH) | ||
| CH2===CH2(SO2) | ||
| CH3COOC2H5(C2H5OH) | ||
| 淀粉(葡萄糖) |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应mA(g) nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原的一半,当达到新的平衡时,B和C的浓度均是原的1.8倍,则
nB(g)+nC(g)达平衡后,保持温度不变,将容器容积压缩到原的一半,当达到新的平衡时,B和C的浓度均是原的1.8倍,则
A.平衡向正反应方向移动 B.物质A的转化率增加
C.物质C的质量分数增加 D.m<2n
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com