
从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、在HCl气体氛围中干燥产物;④将得到的产物熔融电解得到镁。下列说法不正确的是( )
A.此法的优点之一是原料来源丰富
B.第④步电解时阴极产生氯气
C.①②③步骤的目的是从海水中提取MgCl2
D.以上提取镁的过程中涉及化合、分解和复分解反应
科目:高中化学 来源: 题型:
某学生对SO2与漂粉精的反应进行实验探究,下列叙述错误的是( )
| 操作 | 现象 |
| ①取4 g漂粉精固体,加入100 mL水 | 部分固体溶解,溶液略有颜色 |
| ②过滤,测漂粉精溶液的pH | pH试纸先变蓝,最后褪色 |
| ③
| 液面上方出现白雾;稍后,出现浑浊,溶液变为黄绿色;最终,产生大量白色沉淀,黄绿色褪去 |
A.Cl2和Ca(OH)2制取漂粉精的化学方程式是:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
B.pH试纸颜色的变化说明漂粉精溶液具有碱性、漂白性
C.液面上方出现白雾,白雾中一定只含HCl
D.最后,产生大量白色沉淀,黄绿色褪去,推测白色沉淀主要是CaSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除去杂质的方法不正确的是( )
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤
D.MgO中混有少量Al2O3:加入足量烧碱溶液,充分反应,过滤、洗涤、干燥得到MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中既能跟稀硫酸反应,又能跟氢氧化钠溶液反应的是( )
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al
A.全部 B.只有①③④⑤
C.只有③④⑤ D.只有②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
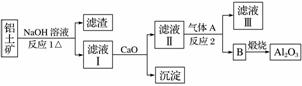
铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。
①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:
②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:
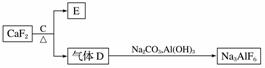
回答下列问题:
(1)写出反应1的化学方程式___________________________________。
(2)滤液Ⅰ中加入CaO生成的沉淀是________,反应2的离子方程式为________________________________________________________________________。
(3)E可作为建筑材料,化合物C是________,写出由D制备冰晶石的化学方程式________________________________________________________________________。
(4)电解法制铝的化学方程式是________,以石墨为电极,阳极产生的混合气体的成分是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
向分别盛有100 mL水、100 mL 0.1 mol·L-1盐酸、100 mL 0.01 mol·L-1硫酸铜溶液的X、Y、Z三个烧杯中各投入0.05 mol Na。下列有关说法正确的是( )
A.三个烧杯中均会发生的离子反应为2Na+2H2O===2Na++2OH-+H2↑
B.三个烧杯中钠均在液面上剧烈反应,且X烧杯中反应最剧烈
C三个烧杯反应后,生成的溶质的物质的量浓度相同
D.三个烧杯反应后,生成的气体的质量一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
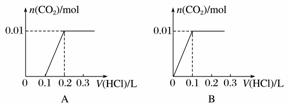
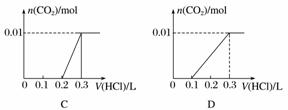
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液能够区别SO2和CO2气体的是( )
①澄清的石灰水 ②H2S溶液 ③酸性KMnO4溶液 ④氯水 ⑤品红溶液
A.①②③ B.②③④
C.除①以外 D.全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com