

分析 【装置选择】
乙醇、乙酸与浓硫酸混合共热发生取代反应生成乙酸乙酯和水;
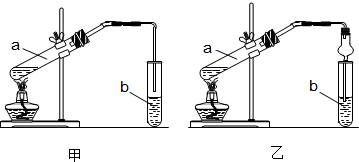
甲装置导管直接插入液面以下容易发生倒吸;球形干燥管容积较大可以防止倒吸;
【实验操作】
(1)浓硫酸密度大,稀释产生大量的热,混合时应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;
(2)乙醇、乙酸易挥发,制备的乙酸乙酯中含有乙醇和乙酸,乙醇易溶于水,乙酸能够与碳酸钠溶液反应,乙酸乙酯在饱和碳酸钠溶液中溶解度不大,所以可以用饱和碳酸钠溶液除去乙醇、乙酸,降低乙酸乙酯的溶解度;
(3)乙酸乙酯密度小于水,不溶于水,有芳香气味,据此判断现象;
(4)酯化反应中浓硫酸作用为:催化剂和吸水剂;
(5)分类两种相互不溶的液体用分液方法.
解答 解:【装置设计】
乙醇与乙酸在浓硫酸做催化剂、吸水剂条件下发生取代反应生成乙酸乙酯和水,方程式:
CH3COOH+CH3CH2OH $?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O;反应类型为:取代反应;
故答案为:CH3COOH+CH3CH2OH $?_{△}^{H_{2}SO_{4}(浓)}$CH3COOCH2CH3+H2O;取代反应;
甲装置导管直接插入液面以下容易发生倒吸;所以应选择乙装置;球形干燥管容积较大可以防止倒吸,
故答案为:乙;防止倒吸;
【实验操作】
(1)浓硫酸密度大,应将浓硫酸加入到乙醇中,以防酸液飞溅,乙酸易挥发,冷却后再加入乙酸;添加顺序依次乙醇、浓硫酸、乙酸,正确的操作为:先在试管中加入一定量的乙醇,然后边加边振荡将浓硫酸慢慢注入试管中,最后再加入乙酸;
故答案为:先在试管中加入一定量的乙醇,然后边加边振荡将浓硫酸慢慢注入试管中,最后再加入乙酸;
(2)乙醇、乙酸易挥发,制备的乙酸乙酯中含有乙醇和乙酸,乙醇易溶于水,乙酸能够与碳酸钠溶液反应,方程式:2CH3COOH+Na2CO3═2CH3COONa+CO2↑+H2O,乙酸乙酯在饱和碳酸钠溶液中溶解度不大,所以可以用饱和碳酸钠溶液除去乙醇、乙酸,降低乙酸乙酯的溶解度,所以在试管②中盛一定量的饱和碳酸钠溶液试剂,
故答案为:饱和碳酸钠溶液;
(3)乙酸乙酯密度小于水,不溶于水,有芳香气味,所以在试管②中观察到的现象是液体分为两层,且能闻到香味;
故答案为:液体分为两层,且能闻到香味;
(4)酯化反应中浓硫酸作用为:催化剂和吸水剂;
故答案为:催化剂和吸水剂;
(5)乙酸乙酯密度小于水,难溶于与水,加入饱和碳酸钠溶液后,二者分层,可以用分液法分离二者;
故答案为:分液;
点评 本题考查乙酸乙酯的制备,明确制备原理及实验装置特点是解题关键,注意实验的基本操作以及浓硫酸混合时的注意事项,易错点是球形干燥管的用途.


科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);△H>0,下列叙述正确的是
Z(g)+W(s);△H>0,下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,一定是n(X)∶n(Y)∶n(Z)=1∶1∶1
C.当容器中气体的平均相对分子质量不变时,一定是v(X)∶v(Y)∶v(Z)=1∶1∶1
D.加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应为可逆反应,不可能进行到底,即乙醇的转化率一定达不到100% | |
| B. | 乙酸挥发,导致其量减少,乙醇过量,不能充分转化为乙酸乙酯 | |
| C. | 产物不稳定,易被氧化为其他物质而影响乙醇的转化率 | |
| D. | 馏出物导入饱和碳酸钠溶液液面上,有较多的乙酸乙酯溶解于水溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业.某学生在实验室利用如图的实验装置制备乙酸乙酯并研究其反应条件.| 物质 | 沸点/°C | 密度/g?cm-3 |
| 乙醇 | 78.0 | 0.79 |
| 乙酸 | 117.9 | 1.05 |
| 乙酸乙酯 | 77.5 | 0.90 |
| 异戊醇 | 131 | 0.8123 |
| 乙酸异戊酯 | 142 | 0.8670 |
| 实验编号 | 试管Ⅰ中的试剂 | 测得有机层的厚度/cm |
| A | 2mL乙醇、2mL乙酸、1mL 18mol/L浓硫酸 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 |
| C | 3mL乙醇、2mL乙酸、6mL 3mol/L硫酸 | 1.2 |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生中和反应 | 不反应 | 溶解 | 生成氢气 |
| B | 不反应 | 有银镜反应 | 有红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 有银镜反应 | 有红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 641.0 kJ•mol-1 | B. | -1 641.0 kJ•mol-1 | ||
| C. | -259.7 kJ•mol-1 | D. | -519.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com