
【题目】下列关于热化学反应的描述中正确的是
A. HCl和NaOH反应的中和热△H=-57.3 kJ·mol1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol1
B. 甲烷的标准燃烧热ΔH=-890.3 kJ·mol1,则CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH<-890.3 kJ·mol1
C. 已知:500℃、30MPa下,N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
2NH3(g) ΔH=-92.4kJ·mol-1;将1.5 mol H2和过量的N2在此条件下充分反应,放出热量46.2 kJ
D. CO(g)的燃烧热是283.0kJ·mol1,则2CO2(g) ===2CO(g)+O2(g)反应的△H=+566.0 kJ·mol1
【答案】D
【解析】
A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,但由于稀硫酸与氢氧化钙反应生成的硫酸钙微溶,则H2SO4和Ca(OH)2反应的中和热的△H≠-57.3kJ/mol,A错误;
B.由于气态水的能量高于液态水的能量,则甲烷完全燃烧生成液态水放热多,但放热越多,△H越小,因此反应CH4(g)+2O2(g)=CO2(g)+2H2O(g)的ΔH>-890.3 kJ·mol-1,B错误;
C.合成氨反应是可逆反应,将1.5 mol H2和过量的N2在此条件下充分反应,放出热量小于46.2 kJ,C错误;
D.CO(g)的燃烧热是283.0kJ/mol,则2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol,互为逆反应时,焓变的数值相同、符号相反,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】(一)已知2A2(g)+B2(g)![]() 2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
2C3(g);△H =-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达平衡时放出热量b kJ。
(1)比较a___b(填“>、=、<”)
(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
A.及时分离出C3气体 B.适当升高温度
C.增大B2的浓度 D.选择高效的催化剂
(3)下图表示此反应的反应速率v和时间t的关系图。根据下图判断,在t1和t4时刻改变的外界条件分别是_______________和 _____________ 。
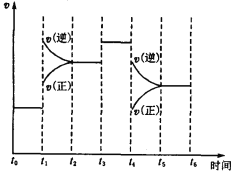
(二)在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)![]() 2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
2NH3(g);△H<0。反应中NH3的物质的量浓度的变化情况如右图所示,请回答下列问题:
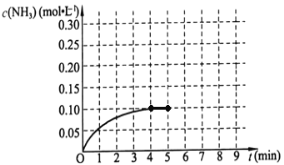
(1)根据上图,该反应达到平衡时H2的转化率等于__________。
(2)第5分钟末,保持其它条件不变,若改变反应温度,达新平衡后NH3的物质的量浓度不可能为_________。(填序号)。
a 0.20mol·L-1 b 0.12 mol·L-1 c 0.10 mol·L-1 d 0.08 mol·L-1
(3)若在第5分钟末将容器的体积缩小一半后,在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol·L-1 ),请在上图中画出第5分钟到9分钟NH3浓度的变化曲线。____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述正确的是( )
A. 浓度均为lmol/L的醋酸和醋酸钠溶液等体积混合,溶液中CH3COOH和CH3COO—的总数为2NA
B. 1molP4所含共价键数目为4mol
C. 1 mol K2S与K2S2的混合物中含离子总数为3NA
D. 25 ℃时,1 L pH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)![]() xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
xC(g)(正反应放热)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)
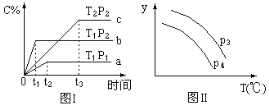
A. P3>P4,y轴表示B的转化率 B. P3<P4,y轴表示B的体积分数
C. P3<P4,y轴表示混合气体的密度 D. P3>P4,y轴表示混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图①②③④表示由不同化学元素组成的化合物,以下说法正确的是
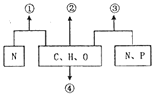
A. 若①为某生物大分子的组成单位,则①最可能是核苷酸
B. 若②是细胞中的储能物质,则②一定是脂肪
C. 若③是病毒的遗传物质,则③一定是RNA
D. 若④是植物细胞壁的主要成分,则④可能是纤维素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有pH=12的NaOH溶液100 mL,若将其pH变为11(溶液混合忽略体积变化;计算结果保留到小数点后一位)。
(1)若用pH=10的NaOH溶液,应加入_________mL。
(2)若用pH=2的盐酸,应加入_________mL。
(3)若用水稀释,则加入水的体积为____________________ mL。
(4)常温下,设pH=5的H2SO4溶液中由水电离出的H+浓度为c1;pH=11的NaOH溶液中由水电离出的H+浓度为c2,则c1/c2=_________。
(5)常温下,pH=11的NaOH溶液aL与pH=5的H2SO4溶液bL混合,若所得混合溶液呈中性,则a∶b=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属及其化合物在生产中用途广泛。
Ⅰ利用生产硼砂的废渣一一确镁泥(主要成分为MgCO3.SiO2,还含有少量Fe2O3、MnO、CaO等)为主要原料制取轻质碳酸镁[MgCO3:Mg(OH)2:2H2O]的工业流程如下:
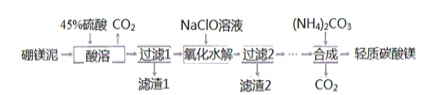
(1)写出“酸溶"一步中,MgCO3和硫酸反应的离子方程式________________________。
(2)滤渣2的主要成分有MnO2和____,写出生成MnO2的离子方程式_____________。
(3)“合成”时需通蒸汽至80℃,边加热边搅拌,温度不能超80℃的原因是________。
II.从含铜丰富的自然资源黄铜矿(CuFeS2)冶炼铜的工艺流程如下:
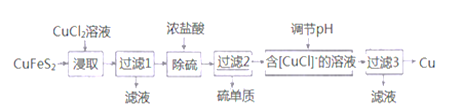
已知:①CuFeS2+3CuCl2=4CuCl↓+FeCl2+2S↓ ②+1价的Cu在酸性条件下易歧化
(4)浸取时,若改用FeCl3溶液,也能生成CuCl和S,该反应化学方程式为_______________。
(5)若过滤1所得滤液中只含FeCl2,则将其在空气中加热蒸干、灼烧后,所得固体的化学式为__________。
(6)调节溶液的pH后,除生成Cu外,还能产生一种金属离子,此金属离子是______。(填离子符号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某澄清透明的溶液中,下列各组离子中能大量共存的是
A. K+、H+、SO42—、OH— B. Ba2+、K+、SO42—、NO3—
C. Na +、H+、Cl—、CO32- D. Na +、Cu2+、Cl-、SO42—
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com