

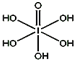
分析 (1)根据图片知,每个S原子含有2个σ键和2个孤电子对,根据价层电子对互斥理论确定S原子杂化方式;
(2)根据第一电离能递变规律判断;
(3)Se元素34号元素,M电子层上有18个电子,分别位于3s、3p、3d能级上;
(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电解,酸性就越弱;
根据价层电子对互斥理论确定气态SeO3分子的立体构型、SO32-离子的立体构型;
(5)①第一步电离后生成的负离子,较难再进一步电离出带正电荷的氢离子;
②根据中心元素Se的化合价可以判断电性高低,电性越高,对Se-O-H中O原子的电子吸引越强,越易电离出H+;
(6)利用均摊法计算晶胞中含有的硫原子和锌原子,根据ρ=$\frac{\frac{M}{N{\;}_{A}}}{V}$计算密度;每个黑色小球连接4个白色小球,构成正四面体结构,白球和黑球之间的夹角为109°28′,两个白球之间的距离=270 $\sqrt{2}$pm,根据余弦定理计算白球和黑球之间的距离.
解答 解:(1)根据图片知,每个S原子含有2个σ键和2个孤电子对,所以每个S原子的价层电子对个数是4,则S原子为sp3杂化,故答案为:sp3;
(2)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱,第一电离能逐渐减小,故答案为:O>S>Se;
(3)Se原子序数为34,其核外M层电子的排布式为3s23p63d10,故答案为:34;3s23p63d10;
(4)非金属性越强的元素,其与氢元素的结合能力越强,则其氢化物在水溶液中就越难电解,酸性就越弱,非金属性S>Se,所以H2Se的酸性比H2S强,气态SeO3分子中Se原子价层电子对个数是3且不含孤电子对,所以其立体构型为平面三角形,SO32-离子中S原子价层电子对个数=3+$\frac{1}{2}$(6+2-3×2)=4且含有一个孤电子对,所以其立体构型为三角锥形,
故答案为:强;平面三角形;三角锥形;
(5)①第一步电离后生成的负离子,较难再进一步电离出带正电荷的氢离子,故H2SeO3和H2SeO4第一步电离程度大于第二步电离,
故答案为:第一步电离后生成的负离子,较难再进一步电离出带正电荷的氢离子;
②H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2.H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,越易电离出H+,H2SeO4比H2SeO3酸性强,
故答案为:H2SeO3和H2SeO4可表示成(HO)2SeO和(HO)2SeO2.H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se-O-H中O的电子更向Se偏移,越易电离出H+;
(6)晶胞中含有白色球位于顶点和面心,共含有8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,黑色球位于体心,共4个,则晶胞中平均含有4个ZnS,质量为4×(87÷6.02×1023)g,晶胞的体积为(540.0×10-10cm)3,则密度为[4×(87÷6.02×1023)g]÷(540.0×10-10cm)3=4.1g•cm-3;
b位置黑色球与周围4个白色球构成正四面体结构,黑色球与两个白色球连线夹角为109°28′,a位置白色球与面心白色球距离为270 $\sqrt{2}$pm,设a位置S2-与b位置Zn2+之间的距离为y pm,由三角形中相邻两边、夹角与第三边关系:y2+y2-2y2cos109°28′=(270$\sqrt{2}$)2,解得y=$\frac{270}{\sqrt{1-cos109°28′}}$,
故答案为:4.1;$\frac{270}{\sqrt{1-cos109°28′}}$.
点评 本题考查了较综合,涉及原子杂化方式判断、粒子空间构型判断、晶胞的计算等知识点,这些知识点都是高考高频点,根据价层电子对互斥理论、元素周期律等知识点来分析解答,注意(4)氢化物酸性强弱比较方法,为易错点.本题难度较大,需要学生具有扎实的基础与灵活运用的能力.利用均摊法计算晶胞中含有的离子,运用余弦定理计算硫离子和锌离子之间的距离为难点.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 除去溴苯中的溴,可加入过量的KI溶液后分液 | |
| B. | 葡萄糖、蔗糖都能与新制氢氧化铜浊液发生反应 | |
| C. | 蛋白质水解的最终产物既能和强酸反应,又能和强碱反应 | |
| D. | 纤维素属于高分子化合物,与淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 0 | 2 | 4 | 6 | 8 |
| V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
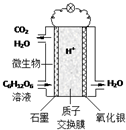 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 电池工作时,H+向石墨电极移动 | |
| B. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| C. | 石墨电极上反应为:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| D. | 该电池每转移4mol电子,石墨电极产生33.6LCO2气体(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
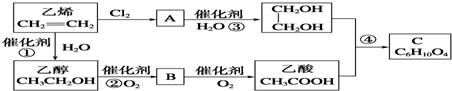
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④>③>①>② | B. | ④>③>②>① | C. | ②>③>④>① | D. | ②>④>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极和负极必须是两种不同的金属 | |
| B. | 电子流入的一极为正极 | |
| C. | 原电池工作时,正极和负极上发生的都是氧化还原反应 | |
| D. | 锌、铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com