
| A.试管 | B.蒸发皿 | C.漏斗 | D.玻璃棒 E.坩埚 F.酒精灯 G.烧瓶 |
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
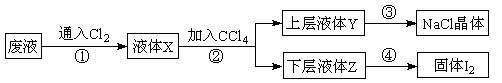
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
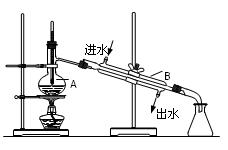
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
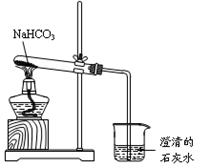
科目:高中化学 来源:不详 题型:实验题
 00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。
00mL0.2000 mol·L-1Na2CO3溶液入锥形瓶中,滴2至3滴甲基橙作指示剂,用未知浓度的盐酸来滴定0.2000 mol·L-1Na2CO3溶液,根据 判断滴定终点达到。 度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)
度升高的平均值为3.41℃,则实验测得中和热△H= (混合后溶液的比热容C = 4.18J·℃-1·g-1),实验测得中和热比理论 (偏高,相等,偏低)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
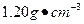 )配制100 mL 0.200
)配制100 mL 0.200 硫酸时,需用酸式滴定管量取24.5%硫酸_______ mL,洗净的酸式滴定管应先 ,再用来量取所需的硫酸。
硫酸时,需用酸式滴定管量取24.5%硫酸_______ mL,洗净的酸式滴定管应先 ,再用来量取所需的硫酸。 的硫酸溶液测定氢氧化钠样品中杂质氯化钠的含量。
的硫酸溶液测定氢氧化钠样品中杂质氯化钠的含量。| 实验编号 | 滴定开始时滴定管的读数为 | 滴定完成时,滴定管的读数为 | 待测溶液的体积 (mL) |
| 1 | 0.07 | 22.59 | 20.00 |
| 2 | 0.22 | 22.72 | 20.00 |
| 3 | 0.35 | 22.83 | 20.00 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.定容后摇匀,发现液面低于刻度线,再加水至刻度线。 |
| B.移液后未洗涤烧杯 |
| C.在容量瓶中进行定容时,俯视刻度线。 |
| D.容量瓶用0.100mol/L HCl进行润洗 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com