
【题目】下列有关电解质溶液的说法正确的是
A. 向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中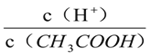 减小
减小
B. 将CH3COONa溶液从20℃升温至30℃,溶液中![]() 增大
增大
C. 向盐酸中加入氨水至中性,溶液中![]() >1
>1
D. 向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中不![]() 变
变
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.100 0 mol·L-1的盐酸滴定20.00 mL未知浓度的氨水,滴定曲线如图所示,滴加20.00 mL盐酸时所得溶液中c(Cl-)=c(NH4+)+c(NH3·H2O)+c(NH3)。下列说法错误的是
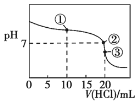
A. 该氨水的浓度为0.100 0 mol·L-1
B. 点①溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=2c(Cl-)
C. 点②溶液中c(NH4+)=c(Cl-)
D. 点③溶液中c(Cl-)>c(H+)>c(NH4+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g·cm-3,溶质的质量分数为w,溶质的物质的量浓度为c mol·L-1。下列叙述中正确的是
A. w=![]() ×100% B. c=
×100% B. c=![]()
C. 若上述溶液中再加入V mL水后,所得溶质的质量分数大于0.5w D. 若上述溶液与0.5V mL同浓度稀盐酸混合,则混合液中c(Cl-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究非金属元素及其化合物的性质具有重要意义。
Ⅰ. 含硫物质燃烧会产生大量烟气,主要成分是SO2、CO2、N2、O2。某研究性学习小组在实验室利用装置测定烟气中SO2的体积分数。
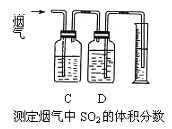
(1)将部分烟气缓慢通过C、D装置,其中C、D中盛有的药品分别是_______、________。(填序号)
①KMnO4溶液 ②饱和NaHSO3溶液 ③饱和Na2CO3溶液④饱和NaHCO3溶液
(2)若烟气的流速为amL/min,若t1分钟后,测得量筒内液体体积为VmL,则SO2的体积分数___________。
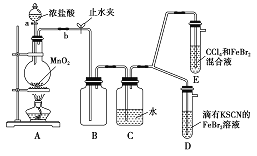
II.某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计如下实验:
(3)检查装置A的气密性:_________________,向分液漏斗中注水,若水不能顺利滴下,则气密性良好。
(4)整套实验装置存在一处明显的不足,请指出:___________________________。
(5)用改正后的装置进行实验,实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为________ |
(6)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
Ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5 ℃,与水发生水解反应。
Ⅲ.AgClO、AgBrO均可溶于水。
Ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。
Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5 ℃,与水发生水解反应。
Ⅲ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因:________________________;可设计简单实验证明上述解释:取少量褪色后的溶液,滴加_____________,若______________,则上述解释合理。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四个干燥的烧瓶,在标准状况下,向①瓶中装入干燥、纯净的氨气,②瓶中装入干燥的含一半空气的氯化氢,③瓶中装入干燥、纯净的二氧化氮,④瓶中装入干燥的体积比V(NO2)∶V(O2)=4∶1的混合气体。做喷泉实验时四个烧瓶中所得溶液的物质的量浓度之比为(不考虑烧瓶中溶液的扩张)( )
A. 2∶1∶2∶2B. 5∶5∶5∶4C. 1∶1∶1∶1D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是汽车安全气囊最理想的气体发生剂原料。工业水合肼法制备叠氮化钠的工艺流程如图所示:

已知:NaN3能与AgNO3反应生成白色难溶于水的AgN3;部分相关物质的物理性质如下表:
熔点℃ | 沸点℃ | 溶解性 | |
CH3OH | 97 | 64.7 | 与水互溶 |
水合肼 (N2H4H2O) | 51.7 | 118.5 | 与水、醇互溶,不溶于乙醚和氯仿 |
亚硝酸甲酯(CH3ONO) | 17 | 12 | 溶于乙醇、乙醚 |
请回答:
(1)步骤Ⅰ中NaNO2与稀硫酸发生副反应生成两种气体(其中一种气体在空气中可以转化为产物中的另一种气体)的离子方程式为_________________________;步骤Ⅱ中生成NaN3的化学方程式为______________________。
(2)实验室模拟步骤Ⅱ,实验装置如图(装置中冷却水省略,下同):
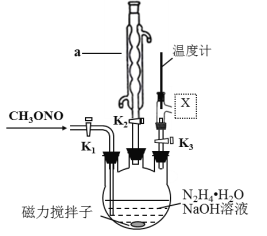
①仪器a的名称为____________,作用是_________________。
②根据实验发现温度在20℃左右反应的选择性和转化率最高,但是该反应属于放热反应,因此可以采取的措施是____________。(合理给分)
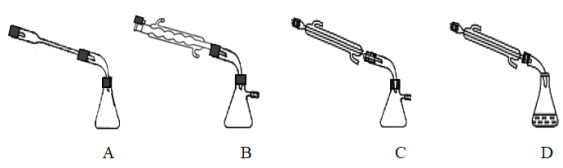
③图中X处连接的最合适装置应为下图中的_________。
(3)步骤Ⅱ中制备叠氮化钠的操作是_______;步骤Ⅲ中溶液A进行蒸馏的合理操作顺序是___________。(填序号)①打开K1、K2,关闭K3 ②打开K3 ③加热 ④关闭K1、K2
(4)步骤Ⅳ对溶液B加热蒸发至溶液体积的1/3,NaN3结晶析出。
①步骤Ⅴ可以用_______洗涤晶体。
A.水 B.乙醚 C.乙醇水溶液 D.乙醇
②沉淀滴定法测定产品纯度,是以淡黄色K2CrO4溶液作指示剂,将AgNO3标准溶液滴入样品溶液,至少量Ag2CrO4出现(即析出橘红色沉淀),达到滴定终点。AgNO3溶液要装在棕色的酸式滴定管里进行滴定,理由是__________。下列操作合理的是______。
A.滴定管管尖不可接触锥形瓶内壁
B.滴定时滴液速度应先快后慢,接近终点时一滴一摇
C.滴定过程中可用蒸馏水将锥形瓶壁上粘附的溶液冲下
D.若未等滴定管液面稳定就读数,会导致测定结果偏高
E.若发现AgNO3溶液滴加过量,可回滴样品溶液,至红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素的叙述,不正确的是( )
A. 氧元素是最基本的元素 B. DNA和磷脂都含有P元素
C. 核酸中的N元素存在于碱基中 D. 蛋白质中的N元素主要存在于肽键中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X、Y、Z、W四种元素原子的电负性数值如表所示:
元素 | X | Y | Z | W |
电负性 | 2.5 | 4.0 | 1.2 | 2.4 |
上述四种元素中,最容易形成共价键的是( )
A.X与YB.X与WC.Y与ZD.Y与W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com