
【题目】(1)在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的燃烧热的热化学方程式应为_________________。
(2)化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH= +436 kJ·mol-1],形成化学键时ΔH<0[如2H(g)=H2(g) ΔH= - 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ·mol-1 ΔH298(H2)=+ 436 kJ·mol-1 ,ΔH298(Cl2)= +247 kJ·mol-1则ΔH298(HCl)=__________________。
【答案】CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ/mol +434 kJ·mol-1
【解析】
(1). 在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则1mol甲醇燃烧生成CO2和液态水时放热22.68kJ×32=725.8kJ,则表示该反应的燃烧热的热化学方程式为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ/mol,故答案为:CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-725.8 kJ/mol;
(2). 已知:H2(g)+Cl2(g)=2HCl(g) ΔH= -185 kJ·mol-1,ΔH298(H2)=+436 kJ·mol-1 ,ΔH298(Cl2)= +247 kJ·mol-1,则ΔH=ΔH298(H2)+ΔH298(Cl2)-2×ΔH298(HCl)=-185 kJ·mol-1,ΔH298(HCl)=![]() (ΔH298(H2)+ΔH298(Cl2)+185 kJ·mol-1)=+434 kJ·mol-1,故答案为:+434 kJ·mol-1。
(ΔH298(H2)+ΔH298(Cl2)+185 kJ·mol-1)=+434 kJ·mol-1,故答案为:+434 kJ·mol-1。


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】有甲、乙两同学想利用原电池反应验证金属的活泼性强弱,两人均用镁片和铝片作电极,但甲同学将两电极放入6 mol/L 的H2SO4溶液中,乙同学将两电极放入6 mol/L的NaOH溶液中,装置如图所示。

(1)写出甲中正极的电极方程式:____;
(2)乙中负极材料为___________;总反应的离子方程式为__________。
(3)甲、乙两同学都认为“如果构成原电池的电极材料都是金属,则作负极的金属应比作正极的金属活泼”,则甲同学得出的结论是_____的活动性更强,乙同学得出的结论是_____的活动性更强。(填元素符号)
(4)由该实验得出的下列结论中,正确的是___(填字母)
A利用原电池反应判断金属活泼性强弱时应注意选择合适的电解质
B镁的金属性不一定比铝的金属性强
C该实验说明金属活泼性顺序表已经过时,没有实用价值
D该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇被称为2l世纪的新型燃料,工业上可以用CH4和H2O为原料来制备甲醇.
(1)将1.0mol CH4和2.0mol H2O(g)通入容积为10L的反应室,在一定条件下发生反应
Ⅰ:CH4(g)+H2O(g)![]() CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图甲:
CO(g)+3H2(g),CH4的转化率与温度、压强的关系如图甲:

已知100℃,压强为P1时,达到平衡所需的时间为5min,
①则用 H2 表示的平均反应速率为______.
②在其它条件不变的情况下升高温度,化学平衡常数将____(填“增大”“减小”或“不变”).
③图中的P1____P2(填“<”、“>”或“=”),在100℃,压强为P1时平衡常数为_______.
④保持反应体系100℃,压强为P1,5min后再向容器中冲入H2O、 H2各0.5mol,化学平衡将向___移动(填“向左”“向右或“不”).
(2)在一定条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下能自发发生反应
Ⅱ:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
①该反应的△H___0,△S___0(填“<”、“>”或“=”).
②若容器容积不变,下列措施可以提高CO转化率的是____.
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿塞那平用于治疗精神分裂症,可通过以下方法合成部分反应条件略去)
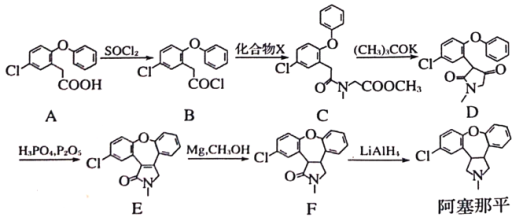
(1)阿塞那平中的含氧官能团名称为___________,由F→阿塞那平的反应类型为___________。物质A的分子式为___________。
(2)A生成B的过程中有SO2产生,写出A→B反应方程式______________________。
(3)化合物X的分子式为C4H9NO2,则X的结构简式为______________________。
(4)由D生成E的过程中先发生加成反应,后发生消去反应,加成反应后生成的中间体的结构简式为___________。
(5)写出同时满足下列条件的B的一种同分异构体的结构简式:__________________。
I属于芳香化合物,分子中含有5种不同化学环境的氢;
Ⅱ能发生银镜反应和水解反应,水解产物能与FeCl3溶液发生显色反应。
(6)参照上述合成流程,写出以CH3NH2和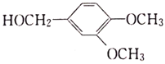 为原料制备
为原料制备 的合成流程(无机试剂任用)______________________。
的合成流程(无机试剂任用)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiOH和钴氧化物可用于制备锂离子电池正极材料。利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液。下列说法不正确的是( )
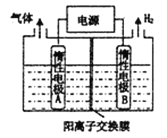
A. B极区电解液为LiOH溶液
B. 每产生2.24L氢气,就有0.2 mol阳离子通过交换膜进入阴极区
C. 电解过程中Li+向B电极迁移
D. 阳极电极反应式为2Cl--2e-=Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C。若维持温度和压强不变,当达到平衡时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是( )
2C。若维持温度和压强不变,当达到平衡时容器的体积为V L,其中C气体的体积占10%。下列推断正确的是( )
①原混合气体的体积为1.2V L ②原混合气体的体积为1.1V L ③反应达到平衡时气体A消耗掉0.05V L④反应达到平衡时气体B消耗掉0.05V L
A. ②③ B. ②④ C. ①③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为探讨反应A(g)+2B(g) ![]() 2C(g)+D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图:图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。
2C(g)+D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图:图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。
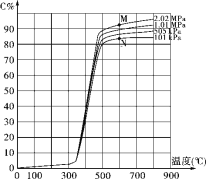
(1)该反应的反应热为ΔH_____0(填“>”、“<”或“=”)。
(2)点M和点N处平衡常数K的大小是:KM______KN(填“>”、“<”或“=”)。
(3)工业上进行该反应获得产品C的适宜条件是:度为______℃,选择该温度的理由是________________,压强为______,选择该压强的理由是__________________ 。
(4)试解释图中350℃前C%变化平缓而后急剧增大、500℃以后又缓慢增加的可能原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁(PFS)是水处理中重要的絮凝剂,以废铁屑为原料制备PFS的具体工艺流程如下:
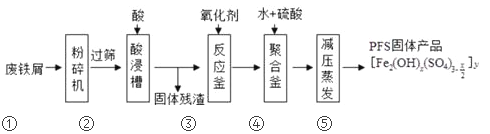
下列说法不正确的是
A. 步骤①,粉碎的目的是为了增大反应物接触面积,提高“酸浸”反应速率
B. 步骤③,可以选择双氧水、氯气等氧化剂将Fe2+转化成Fe3+
C. 步骤④,加稀硫酸调节pH在一定的范围内,让Fe3+部分水解形成碱式盐
D. 步骤⑤,减压蒸发,有利于降低水的沸点防止产物分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com