
����Ŀ����ҵ����1��3������ϩ����ϩ����Ȳ��Ϊԭ�Ϻϳ� ![]() ����ͼ��ͼ
����ͼ��ͼ 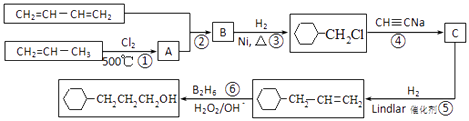
��1����Ӧ�ٵķ�Ӧ������ �� B�к��еĹ����ŵ����� ��
��2��д����Ӧ�ڵĻ�ѧ����ʽ ��
��3��д��C�Ľṹ��ʽ ��
��4��д�� ![]() ������Ԫ���Һ˴Ź���������4����ͬ���칹��Ľṹ��ʽ ��
������Ԫ���Һ˴Ź���������4����ͬ���칹��Ľṹ��ʽ ��
��5���������Ϻϳ���Ϣ������ϩΪԭ�Ϻϳ�1��6���������������Լ���ѡ��д���ϳɵ�����ͼ ��
���𰸡�
��1��ȡ����Ӧ��̼̼˫������ԭ��
��2��![]()
��3��![]()
��4��![]()
��5��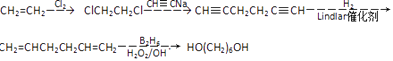
���������⣺�ɷ�Ӧ�ݿ�֪CΪ ![]() ���ɷ�Ӧ�ۿ�֪BΪ
���ɷ�Ӧ�ۿ�֪BΪ ![]() ����AΪCH2=CH��CH2Cl����1����Ӧ����CH2=CH��CH3����CH2=CH��CH2Cl��BΪ
����AΪCH2=CH��CH2Cl����1����Ӧ����CH2=CH��CH3����CH2=CH��CH2Cl��BΪ ![]() ��������ԭ�Ӻ�̼̼˫�������Դ��ǣ�ȡ����Ӧ��̼̼˫������ԭ�ӣ���2����Ӧ��Ϊϩ���ļӳɷ�Ӧ������ʽΪ
��������ԭ�Ӻ�̼̼˫�������Դ��ǣ�ȡ����Ӧ��̼̼˫������ԭ�ӣ���2����Ӧ��Ϊϩ���ļӳɷ�Ӧ������ʽΪ ![]() ��
��
���Դ��ǣ� ![]() ����3���ɷ�����֪CΪ
����3���ɷ�����֪CΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����4��
����4�� ![]() ������Ԫ���Һ˴Ź���������4��壬˵������4��Hԭ�ӣ��ṹ��ʽΪ
������Ԫ���Һ˴Ź���������4��壬˵������4��Hԭ�ӣ��ṹ��ʽΪ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ����5������ϩΪԭ�Ϻϳ�1��6������������������ClCH2CH2Cl��Ȼ����CH��CNa��Ӧ����CH��CCH2CH2C��CH���������������ӳɷ�Ӧ����CH2=CHCH2CH2CH=CH2 �� �������1��6������������Ӧ����Ϊ
����5������ϩΪԭ�Ϻϳ�1��6������������������ClCH2CH2Cl��Ȼ����CH��CNa��Ӧ����CH��CCH2CH2C��CH���������������ӳɷ�Ӧ����CH2=CHCH2CH2CH=CH2 �� �������1��6������������Ӧ����Ϊ 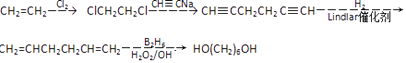 ��
��
���Դ��ǣ� 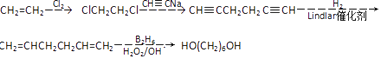 ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���A��
����C��H��O����Ԫ����ɣ���ȼ�շ���ʵ��ⶨ��̼������������64.86%���������������13.51%
����ͼ�Ǹ��л��������ͼ��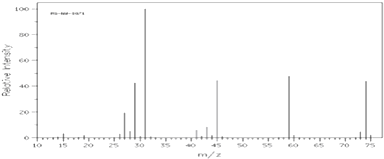
��A�ĺ������ͼ����C��H����O��H����C��O���������շ壮
��A�ĺ˴Ź��������������壮��ش�
��1��A��ʵ��ʽ�����ʽ��Ϊ �� ��Է�������Ϊ ��
��2����֪A�����ʽ�ܷ�ȷ��A�ķ���ʽ����ܡ����ܡ��� �� ������ ��
��3��A�Ľṹ��ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ڹ̶�������ܱ������з������з�Ӧ��2HI��g��=H2��g��+I2��g����c��HI�� ��0.1mol/L ����0.07mol/Lʱ����Ҫ15s����ôc��HI����0.07mol/L����0.05mol/Lʱ�����跴Ӧʱ��Ϊ�� ��
A.����5s
B.����10s
C.����10s
D.��10s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�̼���仯������ת������Դ�ij�����á���̼����������Ҫ�����ã�
��1����֪����CH4��g��+H2O��g��CO��g��+3H2��g����H1=+206.1kJmol��1
��2H2��g��+CO��g��CH3OH��l����H2=��128.3kJmol��1
��2H2��g��+O2��g��2H2O ��g����H3=��483.6kJmol��1
25��ʱ���ں��ʵĴ��������£����ü��������һ���ϳ�Һ̬�״����Ȼ�ѧ����ʽΪ ��
��2�����÷�Ӧ�����Ʊ�������Ϊ��̽���¶ȡ�ѹǿ�Է�Ӧ�����ʡ�ת���ʵ�Ӱ�죬ijͬѧ�������������Ա�ʵ�飨�¶�Ϊ400���500�棬ѹǿΪ101kPa��404kPa����
ʵ����� | �¶ȡ� | ѹǿ/kPa | CH4��ʼŨ��/molL��1 | H2O��ʼŨ��/molL��1 |
1 | 400 | p | 3.0 | 7.0 |
2 | t | 101 | 3.0 | 7.0 |
3 | 400 | 101 | 3.0 | 7.0 |
��ʵ��2��ʵ��3��ȣ���ƽ�ⳣ����ϵ��K2K3�����������������=������
�ڽ������ʵ�����CH4��ˮ��������1L�����ܱ������У�����������Ӧ����400���´ﵽƽ�⣬ƽ�ⳣ��K=27����ʱ������CO���ʵ���Ϊ0.10mol����CH4��ת����Ϊ ��
��3����ѧ�������CO2�� ȡ C��̫���ܹ�����ͼ1��ʾ��
�١�����ϵͳ�������ķ�Ӧ��n��FeO����n��CO2��=6��1����Fe xOy�Ļ�ѧʽΪ ��
�ڡ��ȷֽ�ϵͳ����ÿ�ֽ�l mol Fe xOy �� ת�Ƶ��ӵ����ʵ���Ϊ �� 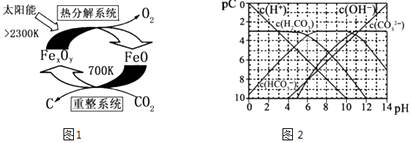
��4��pC����pH����ָ��ϡ��Һ�е�����Ũ�ȵij��ø�����ֵ����ij��Һ�����ʵ�Ũ��Ϊ1��10��3molL��1 �� �����Һ�����ʵ�pC=��lg��1��10��3��=3����ͼ2Ϊ25��ʱH2CO3��Һ��pC��pHͼ����ش��������� ��������Ũ��С��10��5mol/L������Ϊ�����Ӳ����ڣ���
����ͬһ��Һ�У�H2CO3��HCO3����CO32������ܡ����ܡ����������森
����H2CO3һ������ƽ�ⳣ������ֵKa1= ��
������ѪҺ����Ҫͨ��̼�����λ�����ϵ ![]() ���Ե����������ά��pH=7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е�
���Ե����������ά��pH=7.4���������������ѪҺ��ʱ��ѪҺ������ϵ�е� ![]() ���ս� ��
���ս� ��
A�����B����СC����������D�����жϣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������
��1������VSEPRģ���жϣ�������������ԭ�Ӷ���ͬһƽ���ϵ�һ���� ��
A.SO32����NO2��
B.NO3����SO3
C.H3O+��ClO3��
D.PO43����SO32��
��2��CaF2�ľ�����ͼ��ʾ�� 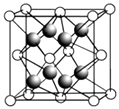
�������й�CaF2�ı�����ȷ����
a��Ca2+��F��������ھ�����������
b��F�������Ӱ뾶С��Cl�� �� ��CaF2���۵����CaCl2
c�����������ӱ�Ϊ2��1�����ӻ��������CaF2���幹����ͬ
d��CaF2�еĻ�ѧ��Ϊ���Ӽ������CaF2������״̬���ܵ���
��CaF2������ˮ���������ں�Al3+����Һ�У�ԭ�����������ӷ���ʽ��ʾ����֪[AlF6]3������Һ�п��ȶ����ڣ���
�۾�����F������λ���� �� ��һ��Ca2+�Ⱦ����������Ca2+������
��3��ͭ��п����Ԫ�صĵ�һ�����ܡ��ڶ������������ʾ
������/kJmol��1 | I1 | I2 |
ͭ | 746 | 1958 |
п | 906 | 1733 |
��д��Cuԭ�Ӻ�������Ų�ʽ��
��ͭ�ĵ�һ�����ܣ�I1��С��п�ĵ�һ�����ܣ���ͭ�ĵڶ������ܣ�I2��ȴ����п�ĵڶ������ܣ�����Ҫԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ʽ��ͬ�����Ȳ���ͬϵ�Ҳ����ͬ���칹����ǣ� ��
A.CH3CH=CH2�� ![]()
B.��Ȳ�ͱ�
C.![]() ��
�� ![]()
D.����������ѿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��ӦA+B�TC+D�������仯��ͼ��ʾ������˵����ȷ���ǣ� �� 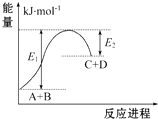
A.�÷�ӦΪ���ȷ�Ӧ
B.�÷�Ӧ���յ�����Ϊ��E1��E2��
C.��Ӧ��������������������������
D.�÷�Ӧֻ���ڼ��������²��ܽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������̼��ȫ������仯����Ҫ������ף�Ϊ����������̼����Ⱦ��ʹ��ת��Ϊ�������ʣ�ȫ����Ļ�ѧ��ѧ�����˴������о�����ѧ���ҵ���һ�����ж������ٵĽ��������ͨ�������������������£�ʹ������̼���ֽ��һ����̼����������һ����̼�����ɻ�ö�����Դ���ʣ���CO��H2���Ժϳɼ״���
��10L���ܱ������а����ʵ���֮��1��2����CO��H2 �� ������10molCO������Ӧ��CO��g��+2H2��g��CH3OH��g����
���ƽ��ʱCO��ת�����S�¶ȱ仯��ѹǿ�ı仯��ͼ��ʾ��
p2��T2ʱ��n��CO����ʱ��ı仯�����ʾ��
t/min | 0 | 1 | 3 | 5 |
n��CO��/mol | 10 | 7 | 5 | 5 |
��1��p2��T2ʱ��0��lmin �ڣ�ƽ�����ʦͣ�H2��=mol/��Lmin����
��2������Ϊp1p2���������������=����
��3���ϳɼ״��ķ�ӦΪ������ȡ������ȡ�����Ӧ��A��B��C�����ƽ�ⳣ��KA��KB��KC�Ĵ�С��ϵΪ ��
��4������ҵ����CH3OH�����д�ʩ�У������ӵ�λʱ����CH3OH�����ķ����� ��
������ѹǿ �ڽ����¶� �������¶�
�ܼ������ ���ʵ�����һ����̼�ı����� ��ʱ����CH3OH
��5����֪̼��ȼ����ΪQ1kJ/mol��̼��������Ӧ����һ����̼������Ͳ�����ȣ��ķ�Ӧ��Ϊ��Q2J/mol���������̼�ڶ�������������ʱ�ֽ���Ȼ�ѧ����ʽ������������ȣ�Ϊ�� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com