


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
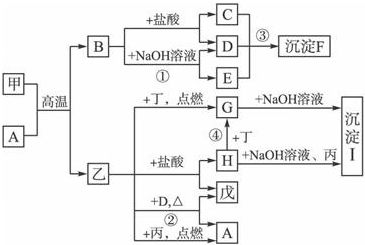 在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.
在一定条件下可实现图所示物质之间的变化,其中甲、乙、丙、丁、戊表示单质,其他字母表示化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
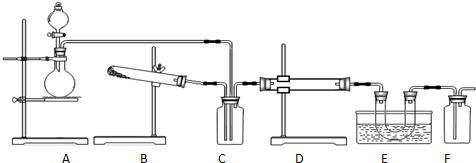
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答下列问题.该小组设计的简单实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | ||
| V | Y | ||
| U | Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
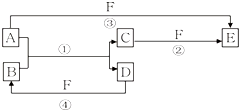 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中A、D是中学化学中常见的单质.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中A、D是中学化学中常见的单质.查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 500℃ |
| A、若降低温度,可以加快反应速率 |
| B、在上述条件下,SO2能完全转化为SO3 |
| C、使用催化剂是为了加快反应速率 |
| D、达到平衡时,SO2和SO3的浓度一定相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com