
常温下,对于pH = 11的NaOH溶液,下列说法错误的是
A.c(OH-) =c(Na+) + c(H+)
B.该溶液中的c(OH-) = 1.0×10-3 mol·L-1
C.与等体积pH = 3的醋酸混合后所得溶液显碱性
D.与等体积0.001 mol·L-1的氯化铵混合后所得溶液中:c(Na+)>c(NH4+)
C
【解析】
试题分析:A.根据电荷守恒可得c(OH-) =c(Na+) + c(H+),正确;B. pH = 11的NaOH溶液, c(H+)= 1.0× 10-11mol/L ,由于在室温下水的离子积是个常数,所以该溶液中的c(OH-) = 1.0×10-3 mol·L-1,正确;C.NaOH是强碱,完全电离,醋酸是弱酸,部分电离,当与等体积pH = 3的醋酸混合后由于酸过量,所以所得溶液显酸性,错误;D.与等体积0.001 mol·L-1的氯化铵混合后所得溶液爱护你以等浓度的NaCl、NH3?H2O,由于一水合氨是弱碱,部分电离,在溶液中存在电离平衡,所以c(Na+)>c(NH4+),正确。
考点:考查溶液中离子浓度大小比较、溶液酸碱性的判断的知识。


科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:实验题
(15分)碘化钠是实验室中常见的分析试剂,常用于医疗和照相业。工业上通常用水合肼(N2H4·H2O,100℃以上分解)还原法制取碘化钠,工艺流程如下:
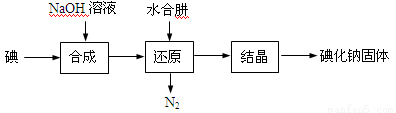
(1)合成过程的反应产物中含有IO3-,写出合成过程的离子方程式 。
(2)还原过程必须保持反应温度在60~70℃,这个温度既能保证反应的快速进行,又能 。工业上也可以用Na2S或Fe屑还原制备碘化钠,但水合肼还原法制得的产品纯度更高,原因是 。
(3)请补充完整检验还原液中是否含有IO3-的实验方案:取适量还原液, 。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液。
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中;
c.用0.1000mol·L-1AgNO3溶液滴定至终点,记录消耗AgNO3溶液的体积;
d.重复b、c操作2~3次,记录相关实验数据。
①滴定过程中,AgNO3溶液应放在 中;步骤d的目的是 。
②若用上述方法测定产品中的NaI含量偏低(忽略测定过程中的误差),其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三第一学期期末考试化学试卷(解析版) 题型:实验题
(16分)利用某地的闪锌矿(主要成分为ZnS,其杂质主要为铁、铜元素等)冶炼纯锌的传统工艺如下:

注:锌、铁、铜的沸点依次为1180K、2862K、1800K
(1)高温焙烧时,若氧气足量,则ZnS发生的化学反应方程式为 。
(2)方案1由锌熔体获得粗锌的的操作为 (填:“蒸馏”、“分馏”或“干馏”)。
(3)工业生产中方案2中固相2的成分为 ,液相1所含金属阳离子为:
(4)方案2中从液相1获取粗锌的过程中可用加入单质 除掉其他杂质;对比两种方案,方案2的优点是 。
(5)方案2的系列操作产生的废液可以制取绿矾。硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示:
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 70 | 80 | 90 |
溶解度 | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 33.5 |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||
从上表数据可以得出的结论是:① ;② 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省深圳市高三第一次调研考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.将高温水蒸气通过炽热的铁粉,铁粉变红色
B.向Fe(OH)3胶体中滴加稀H2SO4,先出现沉淀,后沉淀溶解
C.将市售食盐溶于水,滴加淀粉溶液不变蓝色,说明不是加碘盐
D.Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三学业水平考试理综化学试卷(解析版) 题型:实验题
(16分)MnO2是重要无机材料,某学习小组设计了将粗MnO2(含有较多的MnO、 MnCO3和Fe2O3,其中Fe2O3质量百分含量为10%)样品转化为纯MnO2实验,其流程如下:

(已知:氧化性强弱顺序: ClO3- > MnO2 > Fe3+)
(1)铝与二氧化锰在高温下发生铝热反应,相关反应的化学方程式为: 。
(2)第②步反应离子方程式为: 。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、玻璃棒、 、 ;
第③步蒸发得到的固体中除了含有NaClO3和NaOH外,还一定含有 (写化学式)。
(4)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是: 。
(5)若粗MnO2样品的质量为28.2g,第①步反应后,经过滤得到17.4g MnO2,并收集到448mL CO2(标准状况下),则在第②步反应中至少需要 mol NaClO3才能将Mn2+完全转化为MnO2。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三学业水平考试理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.高纯度硅广泛用于制作光导纤维
B.纤维素、淀粉和蛋白质都是高分子化合物
C.鸡蛋清中加入硫酸铜溶液产生盐析
D.乙酸乙酯和植物油均可水解生成乙醇
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:选择题
某有机物P中碳和氢原子个数比为3∶4,不能与溴水反应却能使酸性KMnO4溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成2种一溴代物。以下说法正确的是
A.P属于烃的衍生物
B.P可以发生加成反应但不能发生取代反应
C.P中含苯环且有可能两个对位取代基
D.P在光照条件下与溴反应,可以生成3种溴代物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市昌平区高二上学期期末考试化学试卷(解析版) 题型:选择题
以下化学用语正确的是
A.乙烯的结构简式CH2CH2 B.乙醇的分子式:CH3CH2OH
C.甲醛的结构式: D.乙酸的结构简式 C2H4O2
D.乙酸的结构简式 C2H4O2
查看答案和解析>>
科目:高中化学 来源:2014-2015四川省绵阳市高一上学期期末化学试卷(解析版) 题型:选择题
足量的铝分别与等物质的量浓度的稀盐酸、氢氧化钠溶液反应,放出的气体在标准状况下体积相等,则所取稀盐酸和氢氧化钠溶液的体积比为
A.3︰1 B.3︰2 C.1︰2 D.6︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com