
【题目】T、W、X、Y、Z为前四周期元素,其原子序数依次增大,有关五种元素的性质或原子结构描述如下:
元素符号 | 元素性质或原子结构 |
T | 其一种无色氧化物遇空气变为红棕色 |
W | 其单质和化合物的焰色反应焰色均呈黄色 |
X | 基态原子的最外层电子排布式为 |
Y | 单质常温下为气体,可用于自来水消毒 |
Z | 一种核素的质量数为56,中子数为30 |
(1)Z元素位于周期表中第_ ______ 族,其基态原子的价层电子排布式为:______ ;
(2)T的一种化合物为![]() ,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
,该分子中极性键和非极性键的数目之比为 ______,T的最低价氢化物与其最高价氧化物的水化物能发生化合反应,其产物属于______ 晶体。
(3)W、X和Y三种元素中,第一电离能最小的为 ______ (填元素符号);W、X和Y的简单离子的半径从小到大的顺序为 ______ (用离子符号表示)。
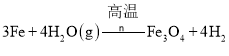
(4)Z与水蒸气反应的化学方程式为:_____。
【答案】VIII ![]() 4:1 离子 Na
4:1 离子 Na ![]()
【解析】
T的某一种无色氧化物遇空气变为红棕色,为NO遇到氧气变成红棕色的二氧化氮,则T为N元素;W的单质和化合物的焰色均呈黄色,则W为Na元素;X的原子的最外层电子排布式为![]() ,
,![]() ,其最外层电子排布为:
,其最外层电子排布为:![]() ,则X为S元素;Y单质常温下为气体,可用于自来水消毒,则Y为Cl元素;Z的一种核素的质量数为56,中子数为30,Z的质子数
,则X为S元素;Y单质常温下为气体,可用于自来水消毒,则Y为Cl元素;Z的一种核素的质量数为56,中子数为30,Z的质子数![]() ,则Z为Fe元素。
,则Z为Fe元素。
![]() 为Fe元素,位于周期表中VIII族,Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:
为Fe元素,位于周期表中VIII族,Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:![]() ,价层电子排布式为:
,价层电子排布式为:![]() ,故答案为:VIII,
,故答案为:VIII,![]() ;
;
![]() 为N元素,则
为N元素,则![]() 为
为![]() ,N原子最外层5个电子,若要满足最外层达到8个电子,每个N原子需要形成3个共价键,其中氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为:
,N原子最外层5个电子,若要满足最外层达到8个电子,每个N原子需要形成3个共价键,其中氮原子和氮原子形成一个共价键,剩余价键和氢原子形成共价键,每个N原子有一个孤电子对,其电子式为:![]() ,则
,则![]() 中存在1个非极性键、4个极性键,该分子中极性键和非极性键的数目之比为4:1;T为N元素,N的最低价氢化物为氨气,其最高价氧化物的水化物为硝酸,氨气与硝酸能发生化合反应生成硝酸铵,硝酸铵为离子晶体, 故答案为:4:1;离子;
中存在1个非极性键、4个极性键,该分子中极性键和非极性键的数目之比为4:1;T为N元素,N的最低价氢化物为氨气,其最高价氧化物的水化物为硝酸,氨气与硝酸能发生化合反应生成硝酸铵,硝酸铵为离子晶体, 故答案为:4:1;离子;
![]() 、X和Y三种元素分别为Na、S、Cl,同一周期中随着原子序数的递增,第一电离能呈减小趋势,则第一电离能最大的为Na;离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则三种离子大小为:
、X和Y三种元素分别为Na、S、Cl,同一周期中随着原子序数的递增,第一电离能呈减小趋势,则第一电离能最大的为Na;离子的电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则三种离子大小为:![]() , 故答案为:Na;
, 故答案为:Na;![]() ;
;
![]() 为Fe,铁与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:
为Fe,铁与水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:![]()
![]()
![]() 。
。


科目:高中化学 来源: 题型:
【题目】常温下,下列有关溶液的说法正确的是( )
A.NaHCO3溶液加水稀释,c(Na+)与c(HCO3-)的比值将减小
B.pH=1的一元酸和pH=13的一元碱等体积混合后溶液不一定呈中性
C.0.1mol/L硫酸铵溶液中:![]()
D.0.1mol/L的硫化钠溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将M和N两种气体通入2 L密闭容器中,发生反应如下:xM(g)+yN(g)![]() 2P(g)。2s内的反应速率:v(M)=1.5 mol·L-1·s-1,v(N)=4.5 mol·L-1·s-1,v(P)=3.0 mol·L-1·s-1。则x积y的值分别为
2P(g)。2s内的反应速率:v(M)=1.5 mol·L-1·s-1,v(N)=4.5 mol·L-1·s-1,v(P)=3.0 mol·L-1·s-1。则x积y的值分别为
A.2和3B.3和2C.3和1D.1和3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼、镁及其化合物在工农业生产中应用广泛。
Ⅰ.已知硼镁矿的主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。一种利用硼镁矿制取金属镁及粗硼的工艺流程如图所示:

(1)硼砂中B元素的化合价为________,将硼砂溶于热水后,用硫酸调节溶液的pH为2~3以制取H3BO3,该反应的离子方程式为______________________;X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为___________________。
(2)由MgCl2·6H2O制备MgCl2时,需要在HCl氛围中加热,其目的是__________。
(3)Mg—H2O2酸性燃料电池的反应原理为Mg+H2O2+2H+===Mg2++2H2O。常温下,若起始电解质溶液pH=1,则pH=2时,溶液中所含Mg2+的物质的量浓度为__________;已知常温下,Ksp[Mg(OH)2]=5.6×10-12,当电解质溶液的pH=6时,_____(填“有”或“无”)Mg(OH)2沉淀析出 (忽略反应过程中溶液的体积变化)。
Ⅱ.工业上可用纳米MgH2和LiBH4组成的体系储放氢,如图所示。

(4)写出放氢过程中发生反应的化学方程式____________________。
Ⅲ.MgO浆液是一种高活性的脱硫剂,常用于脱除烟气中的SO2,发生的主要反应如下:

Mg(OH)2+SO2===MgSO3+H2O
MgSO3+SO2+H2O===Mg(HSO3)2
Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
2MgSO3+O2===2MgSO4
已知25 ℃时,Ksp(MgSO3)=3.86×10-3,Ksp(CaSO3)=3.1×10-7。
(5)其他条件相同时,镁基和钙基的脱硫效率与液、气摩尔流量比的变化情况如图所示。镁基的脱硫效率总是比钙基的大,除生成的MgSO4具有良好的水溶性外,还因为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是常温下向20.0 mL的盐酸中,逐滴加入0.10 mol·L-1 NaOH溶液时,溶液的pH随 NaOH溶液的体积V(mL)变化的曲线,根据图像所得的下列结论中正确的是

A. 原盐酸的浓度为0.10 mol·L-1
B. x的值为2.0
C. 当pH=12时,V值为20.4
D. 原盐酸的浓度为1.0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
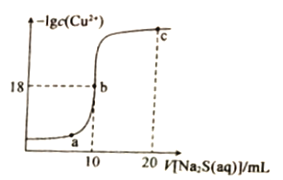
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B. Ksp(CuS)的数量级为10-36
C. a、b、c三点溶液中,b点水的电离程度最大
D. c点溶液中:c(C1-)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,向等浓度的NaCl和Na2CrO4溶液中分别滴加AgNO3溶液(已知:Ag2CrO4为砖红色),平衡时溶液中相关离子浓度的关系如图所示。下列说法正确的是( )

A.L1为向Na2CrO4溶液中滴加AgNO3溶液时的离子浓度关系曲线
B.Ksp(AgCl)的数量级为10-12
C.L1和L2交点处对应的两种溶液中c(Ag+)=c(Cl-)=c(CrO42-)
D.用AgNO3标准溶液测定溶液中Cl-含量时可用Na2CrO4做指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是( )
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 锌 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
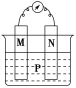
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是( )
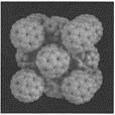
A. C60摩尔质量是720
B. C60与苯互为同素异形体
C. 在C60晶胞中有14个C60分子
D. 每个C60分子周围与它距离最近等距离的C60分子有12个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com