
10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成的是( )
A.K2SO4 B.CH3COONa C.CuSO4 D.Na2CO3
【答案】A、B
【解析】Zn与稀盐酸发生反应:Zn+2HCl=ZnCl2+H2↑,若加入物质是反应速率降低,则c(H+)减小。但是不影响产生氢气的物质的量,说明最终电离产生的n(H+)不变。A、K2SO4是强酸强碱盐,不发生水解,溶液显中性,溶液中的水对盐酸起稀释作用,使c(H+)减小,但没有消耗H+,因此n(H+)不变,符合题意,正确;B、CH3COONa与HCl发生反应:CH3COONa+HCl=CH3COOH+NaCl,使溶液中c(H+)减小,反应速率降低,当反应进行到一定程度,会发生反应:2CH3COOH+Zn= (CH3COO)2Zn+ H2↑,因此最终不会影响产生氢气的物质的量,正确;C、加入CuSO4溶液会与Zn发生置换反应:CuSO4+Zn=Cu+ZnSO4,产 生的Cu与Zn和盐酸构成原电池。会加快反应速率,与题意不符合,错误;D、若加入Na2CO3溶液,会与盐酸发生反应:Na2CO3+2HCl=2NaCl2+H2O+CO2↑,使溶液中溶液中的c(H+)减小,但由于逸出了CO2气体,因此使n(H+)也减小,产生氢气的物质的量减小,不符合题意,错误。
生的Cu与Zn和盐酸构成原电池。会加快反应速率,与题意不符合,错误;D、若加入Na2CO3溶液,会与盐酸发生反应:Na2CO3+2HCl=2NaCl2+H2O+CO2↑,使溶液中溶液中的c(H+)减小,但由于逸出了CO2气体,因此使n(H+)也减小,产生氢气的物质的量减小,不符合题意,错误。
【考点定位】考查影响化学反应速率速率的因素。
【名师点睛】本题将外界条件对化学反应速率速率的影响因素与物质之间的反应、弱电解质的电离和原电池原理的应用结合在一起考查浓度为化学反应速率的影响、原电池反应能加快化学反应速率,考查学生分析问题、解决问题的能力。
【注】本题分类于专题11、12


科目:高中化学 来源: 题型:
对羟基苯甲酸丁酯(俗称尼泊金丁酯)可用做防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得。以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯甲酸丁酯的合成路线:
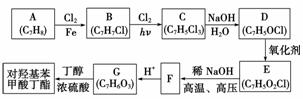
已知以下信息:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
②D可与银氨溶液反应生成银镜;
③F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶1。
回答下列问题:
(1)A的化学名称为______;
(2)由B生成C的化学反应方程式为__________________________________,该反应的类型为________;
(3)D的结构简式为__________;
(4)F的分子式为__________;
(5)G的结构简式为__________;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有______种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2∶2∶1的是__________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.Ksp只与难溶电解质的性质和温度有关
B.由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀
C.其他条件不变,离子浓度改变时,Ksp不变
D.两种难溶电解质作比较时,Ksp小的,溶解度一定小
查看答案和解析>>
科目:高中化学 来源: 题型:
I.在体积为2L的密闭容器中,加入1mol A与4mol B发生反应:
A(g)+ 2B(g) 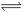 2 C(g) △H= QkJ/mol。达平衡时A的转化率α与温度的变化如下表。
2 C(g) △H= QkJ/mol。达平衡时A的转化率α与温度的变化如下表。
| 温度℃ | 200 | 300 | 500 |
| α | 0.5 | 0.4 | 0.3 |
(1)Q 0(填< 、>、=)。
(2)在200℃时,若经5min达到平衡,则用物质C表示的平均速率为 。
(3)200℃时,将容器体积压缩为1L,平衡时的平衡常数K= 。
II.已知:
由常见的有机物A[CH2=C(CH3)2]可以实现如下的转化:
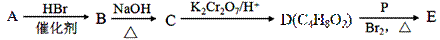
(1)A的系统命名为 ;B→C的反应类型是 。
(2)C的一种同类别的同分异构体M,M能发生催化氧化反应生成醛,则M 的结构简式为 。
(3)写出E与足量的氢氧化钠溶液共热反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A.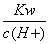 <1.0×10-7mol/L
<1.0×10-7mol/L
B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。
(1)久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。
(2)已知Ksp(AgCl)=1.8×10-10,若向50mL0.018mol·L-1的AgNO3溶液中加入50mL0.020mol·L-1的盐酸,混合后溶液中的Ag+的浓度为 mol·L-1,pH为 。
(3)AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。
(4)右图所示原电池正极的反应式为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)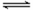
 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H—H | C—O | C | H—O | C—H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为 ;图1中 能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。

(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25°C、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+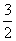 O2(g)===CO2(g)+2H2O(l) ΔH=+725.8 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=+725.8 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 452 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.8 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=+1 452 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com