
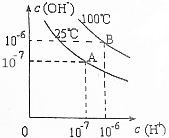
| A. | 25℃时,0.1mol/LNaOH溶液与0.1mol/L乙酸溶液等体积混合,所得溶液的pH等于7 | |
| B. | 25℃时,pH=11的氨水与pH=3的盐酸等体积混合,所得溶液的pH小于7 | |
| C. | 100℃时,pH=12的NaOH溶液aL和pH=2的H2SO4溶液bL恰好中和,则a:b=1:1 | |
| D. | 100℃时,pH=12的NaOH溶液和pH=9的NaOH溶液等体积混合,所得溶液的pH约为11.7 |
分析 根据图示可知,25℃时水的离子积为10-14,100℃时水的离子积为10-12,
A.乙酸为弱酸,反应生成强碱弱酸盐乙酸钠,溶液呈碱性;
B.氨水为弱碱,混合液中氨水过量,所得溶液呈碱性;
C.100℃时,pH=12的NaOH溶液中氢氧根离子浓度为1mol/L,pH=2的H2SO4溶液中氢离子浓度为0.01mol/L,两溶液恰好中和时氢离子与氢氧根离子的物质的量相等,据此计算出a:b;
D.100℃时,pH=12的NaOH溶液中氢氧根离子浓度为1mol/L,pH=9的NaOH溶液中氢氧根离子浓度为10-3mol/L,先计算出混合液中氢氧根离子的浓度,然后结合水的离子积计算出混合液中氢离子浓度,最后根据pH=-lgc(H+)计算出混合液的pH.
解答 解:根据图示可知,25℃时水的离子积为:10-7×10-7=10-14,100℃时水的离子积为:10-6×10-6=10-12,
A.25℃时,0.1mol/LNaOH溶液与0.1mol/L乙酸溶液等体积混合,反应生成乙酸钠,乙酸根离子水解,溶液呈碱性,所得溶液的pH大于7,故A错误;
B.25℃时,pH=11的氨水与pH=3的盐酸等体积混合,由于氨水为弱碱,则混合液中氨水过量,所得溶液呈碱性,溶液的pH大于7,故B错误;
C.100℃时水的离子积为:10-6×10-6=10-12,pH=12的NaOH溶液中氢氧根离子浓度为:$\frac{1{0}^{-12}}{1{0}^{-12}}$mol/L=1mol/L,pH=2的H2SO4溶液中氢离子浓度为0.01mol/L,由于两溶液恰好中和,则氢离子与氢氧根离子的物质的量相等,即:1mol/L×aL=0.01mol/L×bL,整理可得:a:b=1:100,故C错误;
D.100℃时,pH=12的NaOH溶液中氢氧根离子浓度为:$\frac{1{0}^{-12}}{1{0}^{-12}}$mol/L=1mol/L,pH=9的NaOH溶液中氢氧根离子浓度为:$\frac{1{0}^{-12}}{1{0}^{-9}}$mol/L=10-3mol/L,混合液中氢氧根离子浓度为:$\frac{1mol/L+0.001mol/L}{2}$≈$\frac{1}{2}$mol/L,混合液中氢离子浓度为:$\frac{1{0}^{-12}}{\frac{1}{2}}$mol/L=2×10-12mol/L,则所得溶液的pH=-lgc(H+)=-lg2×10-12=12-lg2=11.7,故D正确;
故选D.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握弱电解质部分电离的特点,试题培养了学生的分析能力及灵活应用能力.


 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属活动性A>B | |
| B. | 还原性B>A | |
| C. | 在后者装置中金属A发生还原反应,金属B发生氧化反应 | |
| D. | 金属B的表面上明显有气泡产生,金属A表面无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
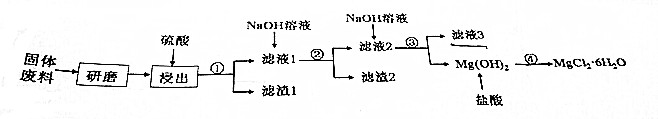
| A. | “浸出”步聚中,可适当提高反应温度、增加浸出时间提高镁的浸出率 | |
| B. | 滤渣1的主要成分是CaSO4,滤液3的主要成分是Na2SO4 | |
| C. | 第1次加Na0H溶液需控制PH的目的是除去Cu2+和Al3+ | |
| D. | ①②③的操作步骤都是过滤,④的操作步骤是蒸发浓缩、冷却结晶、过滤. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从阴离子HS-电离出H+比从H2S电离出H+更难 | |
| B. | H2S电离出的H+会抑制HS-的电离 | |
| C. | 溶液中c(H+)与c(HS-)接近于相等且c(H+)略大于c(HS-) | |
| D. | 溶液中c(H+)=2c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通入Cl2后,装置Ⅰ中发生了氧化还原反应 | |
| B. | Cl2与Na2SO3溶液反应的离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ | |
| C. | 导气管末端不应该伸入到液面以下 | |
| D. | 若将装置Ⅰ中Na2SO3改成NaOH溶液,现象完全相同 |
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上第二次月考化学试卷(解析版) 题型:填空题
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。问:
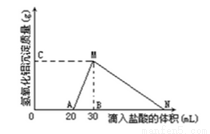
(1)此溶液中同时含有____________mol______离子;
(2)用离子方程式表示MN段发生的反应是________________________
(3)C(或M)点的纵坐标为0.78,则c(AlO2-)________________
(4)点B的横坐标为30,则到点N处滴入的HCl溶液体积为__________mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com