

| A、图Ⅰ所示锌锰碱性电池正极的电极反应式为:MnO2+H2O+2e-═MnOOH+OH- |
| B、图Ⅱ表示盐酸滴加到0.1 mol?L-1某碱溶液中得到的滴定曲线,由图Ⅱ可知二者恰好中和时,所得溶液的pH>7 |
| C、图Ⅲ表示某明矾溶液中加入Ba(OH)2溶液时,沉淀的质量与加入Ba(OH)2溶液体积的关系,在加入20 mL Ba(OH)2溶液时,沉淀全部是BaSO4 |
| D、图Ⅳ表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |


科目:高中化学 来源: 题型:
| ||

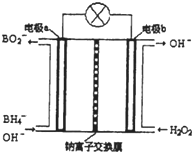
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径C>D>A>B |
| B、原子序数b>a>d>c |
| C、单质的还原性A>B>C>D |
| D、离子半径D>C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滤液b的pH=7 |
| B、②中颜色变化说明Mg(OH)2转化为Fe(OH)3 |
| C、实验可以证明Fe(OH)3的溶解度比Mg(OH)2的小 |
| D、浊液a中存在沉淀溶解平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B、HCO3-的电离程度大于HCO3-的水解程度 |
| C、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| D、存在的电离只有:NaHCO3=Na++HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,若转移了NA个电子,则阴极析出32g铜 |
| B、标准状态下,33.6L氟化氢中含有1.5NA个氟化氢分子 |
| C、0.1mol/L的Al2(SO4)3溶液中,Al3+的数目小于0.2NA |
| D、1mol FeCl3跟水反应,完全转化为氢氧化铁胶体后,其中胶体粒子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(OH-) |
| c(H+) |
| A、该一元酸溶液的pH=1 | ||
| B、该溶液中HA的电离度为1% | ||
| C、该溶液中水的离子积常数为1×10-22 | ||
D、若加水稀释,则
|
查看答案和解析>>
科目:高中化学 来源: 题型:
2- 3 |
| A、上述反应中的氧化剂是Cl2 |
| B、该反应过程中只有氮元素被氧化 |
| C、还原性:CN->Cl- |
| D、当有1 molCl2参加反应时,转移的电子数为2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水.
5种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水.| 阳离子 | Na+ Al3+Fe3+ Cu2+ Ba2+ |
| 阴离子 | OH- Cl- CO32- NO3- SO4- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com