
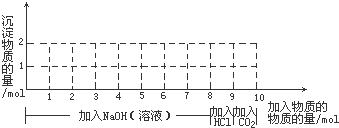
分析 (1)含1molFe3+和1molAl3+的混合溶液中,加6molNaOH两种离子完全转化为沉淀,再加1molNaOH时Al(OH)3完全溶解生成偏铝酸根离子,7~8mol时加NaOH不发生反应,8~9mol时加盐酸,发生酸碱中和,9~10mol通入CO2气体,偏铝酸根离子转化为Al(OH)3,碳酸根离子转化为碳酸氢根离子;
(2)通入CO2后,也就是9-10为偏铝酸根离子转化为Al(OH)3及碳酸根离子转化为碳酸氢根离子的反应.
解答 解:(1)含1molFe3+和1molAl3+的混合溶液中,加6molNaOH两种离子完全转化为沉淀,再加1molNaOH时Al(OH)3完全溶解生成偏铝酸根离子,7~8mol时加NaOH不发生反应,8~9mol时加盐酸,发生酸碱中和,9~10mol通入CO2气体,偏铝酸根离子转化为Al(OH)3,碳酸根离子转化为碳酸氢根离子,沉淀的物质的量随反应的变化曲线为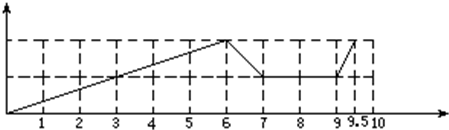 ,
,
故答案为: ;
;
(2)9-10为偏铝酸根离子转化为Al(OH)3及碳酸根离子转化为碳酸氢根离子的反应,发生的反应为CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-、CO2+CO32-+H2O=2HCO3-,
故答案为:CO2+2AlO2-+3H2O=2Al(OH)3↓+CO32-;CO2+CO32-+H2O=2HCO3-.
点评 本题考查离子反应方程式的书写,明确加入物质发生的化学反应及反应与图象的对应关系是解答本题的关键,并利用离子反应方程式的书写方法来解答,题目难度中等.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 离子半径:X+>Y3+>Z2- | B. | 原子序数:Y>X>Z | ||
| C. | 电负性:Z>Y>X | D. | 单质的还原性:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.8g | B. | 5.6g | C. | 11.2g | D. | 22.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.
某温度下的溶液中,c (H+)=10x mol/L,c (OH-)=10y mol/L.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
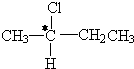 中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.某链烃C7H10的众多同分异构体中:
中带*的C原子.若同一个碳原子上连着2个碳碳双键(如C═C═C)时,分子极不稳定,不存在.某链烃C7H10的众多同分异构体中:
 、
、 .
.  .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时仰视容量瓶的刻度线 | |
| B. | 在用蒸馏水洗涤烧杯时,洗涤液未全部转移到容量瓶中 | |
| C. | 配制盐酸溶液用量筒量取浓盐酸时仰视刻度线 | |
| D. | 用来配制溶液的容量瓶用蒸馏水洗涤后未进行干燥处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com