
| A. | +45.2 kJ•mol-1 | B. | -45.2 kJ•mol-1 | C. | +69.4 kJ•mol-1 | D. | -69.4 kJ•mol-1 |
分析 25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,但是弱碱的电离吸热,根据题干信息写出反应的热化学方程式,然后利用盖斯定律计算出NH3•H2O在水溶液中电离的△H.
解答 解:NH3•H2O(aq)与H2SO4(aq)反应生成1mol正盐的△H=-24.2kJ/mol,则:2NH3•H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O (l)△H=-24.2kJ/mol
即:2NH3•H2O(aq)+2H+=2NH4+(aq)+2H2O(l)△H=-24.2kJ/mol,
整理可得:NH3•H2O(aq)+H+=NH4+(aq)+H2O(l)△H=-12.1kJ/moL (1)
H+(aq)+OH-(aq)=H2O (l)△H=-57.3kJ/mol (2)
(1)-(2)可得:NH3•H2O(aq)=NH4+(aq)+OH-(aq),△H=+45.2kJ/mol,
所以NH3•H2O在水溶液中电离的△H为+45.2kJ/mol,
故选A.
点评 本题考查盖斯定律在热化学方程式计算中的应用,题目难度中等,明确中和热是指强酸与强碱的稀溶液发生中和反应生成1mol水所放出的热量、弱碱的电离吸热是解题关键.


科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石灰石 | B. | 氢硫酸、烧碱、绿矾 | ||
| C. | 石炭酸、熟石膏、醋酸钠 | D. | 磷酸、乙醇钠、苛性钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
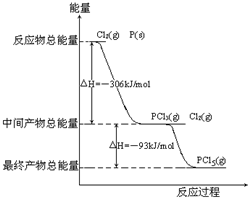 红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题:
红磷P(s)和Cl2发生反应生成PCl3和PCl5,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据如图回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应不一定是吸热反应 | |
| B. | 化学反应中的能量变化都表现为热量变化 | |
| C. | 向醋酸钠溶液中滴入酚酞试液,加热后若溶液红色加深,则说明盐类水解是吸热的 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化铝溶液中滴加过量氨水,最终得到澄清溶液 | |
| B. | 常温下铝、铁可以与盐酸分别反应生成Al Cl3和Fe Cl3 | |
| C. | 等质量的铝分别与足量的盐酸和足量的氢氧化钠溶液反应制得等质量的氢气 | |
| D. | Al Cl3溶液加热蒸干得到无水氯化铝晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂 | B. | 改变压强 | ||
| C. | 适当提高反应温度 | D. | 将尾气点燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2O | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| D. | 稀硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com