
| A. | 增大压强 | B. | 使用合适的催化剂 | ||
| C. | 增多反应物的用量 | D. | 增大反应的温度 |
科目:高中化学 来源: 题型:实验题
 氨在生活、生产、科研中有广泛用途.
氨在生活、生产、科研中有广泛用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 |
| A | 加热放在坩埚中的小钠块 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化,失去光泽,熔化的铝并不滴落,好像有一层膜兜着 |
| C | 在含有酚酞的水中加入一小块钠 | 钠浮在水面上,四处游动,发出嘶嘶响声,溶液变红 |
| D | 在空气中久置的铝条放入稀硫酸溶液中 | 立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化剂和还原剂物质的量之比为5:4 | |
| B. | 3 mol H2S可还原4mol的KIO3 | |
| C. | I2是还原产物,K2SO4是氧化产物 | |
| D. | 1molKIO3可氧化0.2mol的KI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未冷却就转移、定容 | B. | 容量瓶内原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 定容时加多了水再用吸管吸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
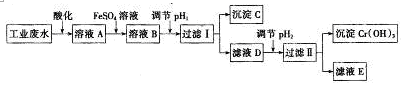
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 先配制一定量的0.10mol/LCH3COOH溶液,然后测溶液的c(H+),若c(H+)小于0.10mol/L,则可证明醋酸为弱电解质 | |
| B. | 先配制一定量0.0010mol•L-1和0.10mol•L-1的CH3COOH,分别用pH计测它们的c(H+),若前者的c(H+)与后者c(H+)的比值小于10,则可证明醋酸是弱电解质 | |
| C. | 取等体积、等c(H+)的CH3COOH溶液和盐酸分别于足量等规格的锌粒反应,若反应过程中醋酸产生H2较慢且最终产生H2较多,则可证明醋酸是弱电解质 | |
| D. | 取等体积、等c(H+)的CH3COOH溶液和盐酸分别加水稀释相同的倍数,若稀释后CH3COOH溶液中c(H+)大,则可证明醋酸是弱电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com