
(1)FeSO4·7H2O(名称、俗名亦可) 硫酸(H2SO4)
(2)防止Fe2+被氧化(合理答案均计分)
(3)TiO2+2Cl2+2C高温TiCl4+2CO(3分)(写CO2也给分)
(4)①酸污染 ②重金属离子(Cu2+、Cr3+等)污染(合理答案均计分)
中和法、沉淀法(合理答案均计分)
解析试题分析:(1)从流程图硫酸与过量的铁反应可知,副产品甲是FeSO4·7H2O,可循环利用的物质是硫酸。
(2)生产流程中加入铁屑的目的是防止Fe2+被氧化;
(4)“硫酸法”是酸性,会产生酸污染;与Ti共存的其它重金属的废液对水体有污染。
产生酸污染可以加入石灰中和,重金属离子污染可通过沉淀法除去。
考点:化学与技术。考查工业流程中使用和得到的产品物质,循环利用物质,废水的污染问题及处理措施。


科目:高中化学 来源: 题型:填空题
[化学选修——2:化学与技术](15分)
将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一。一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品。
回答下列问题:
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是 (填序号)。
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收。碱吸收溴的主要反应是:Br2+Na2CO3+H2O  NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
NaBr + NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为 mol。
(3)海水提镁的一段工艺流程如下图:
浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为 ,产品2的化学式为 ,1L浓海水最多可得到产品2的质量为 g。
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为 ;电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
精细化学品具有品种多、批量少、产值高的特点。
(1)表面活性剂在工农业生产和日常生活中广泛应用,其优点是______________,能显著降低水与空气或其他物质的________,提高工业生产________,提高产品的________,故表面活性剂被称为_________________。
(2)在泡沫灭火器中添加表面活性剂可以提高灭火效果的原因是什么?
(3)精细化学品具有特定的功能,特殊的用途,如有些洗衣粉适用于洗衣机,加酶洗衣粉不能用于洗涤____________,医药和农药都有严格的________、__________等。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
丙酸的结构为CH3—CH2—COOH,丙酸盐是安全有效的防霉、防腐剂,一种以碱式碳酸锌为原料的生产工艺流程如下: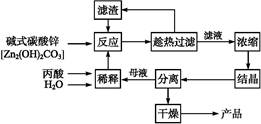
| 序号 | n(丙酸)∶ n(碱式碳酸锌) | 反应温度/℃ | 丙酸锌产率/% |
| 1 | 1∶0.25 | 60 | 67.2 |
| 2 | 1∶0.25 | 80 | 83.5 |
| 3 | 1∶0.25 | 100 | 81.4 |
| 4 | 1∶0.31 | 60 | 89.2 |
| 5 | 1∶0.31 | 80 | 90.1 |
| 6 | 1∶0.31 | 100 | 88.8 |
 ,反应温度 ℃。
,反应温度 ℃。 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。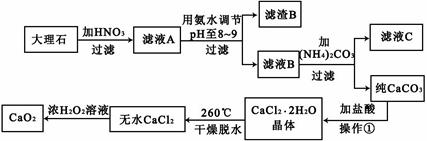
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以白云石(化学式表示为MgCO3·CaCO3)为原料制备氢氧化镁的工艺流程如下:

(1)根据流程图判断白云石“轻烧”后固体产物的主要成份 _____ 。则“轻烧”温度应不超过 _____ 。
(2)流程图中“加热反应”的化学方程式为 _ _________________________ 。
(3)沉淀过程溶液的pH=9.5,此时溶液中c(Mg2+)= _______ (已知Ksp[Mg(OH)2]=5.61×10-12)。
(4)该工艺中可以循环使用的物质是 、 (填化学式)。
(5)传统工艺将白云石分解为氧化镁和氧化钙后提取,该工艺采用轻烧白云石 的方法,其优点是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
已知以下四种物质的溶解度曲线图:
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为 。
| 物质 | 电离常数(25℃) |
| H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
| H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO,下列叙述正确的是( )。
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3价 |
| D.氮化铝属于复合材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com