
| A、用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,读取滴定管末读数时,仰视刻度线 |
| B、测定硫酸铜晶体中结晶水含量的实验时,加热时间过短未完全变白 |
| C、中和滴定时,加待测液前锥形瓶内有少量水 |
| D、测定1mol氢气体积的操作中,反应结束后未抽气 |


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案 小学学习好帮手系列答案
小学学习好帮手系列答案科目:高中化学 来源: 题型:
| A、c(H+)/c(OH-)=1012的水溶液中:NH4+、Al3+、NO3-、Cl- |
| B、水电离出的c(H+)=10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| C、pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ |
| D、c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:
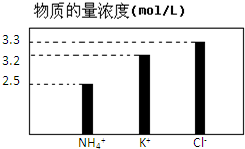 在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )
在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )| A、2、64、24 |
| B、16、50、24 |
| C、32、50、12 |
| D、64、2、24 |
查看答案和解析>>
科目:高中化学 来源: 题型:
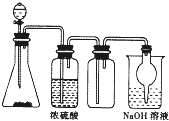 如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各实验能利用这套装置进行的是( )
如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各实验能利用这套装置进行的是( )| A、MnO2和浓盐酸制氯气 |
| B、锌粒和稀硫酸制氢气 |
| C、铜片和浓硝酸制二氧化氮 |
| D、浓氨水和生石灰制氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
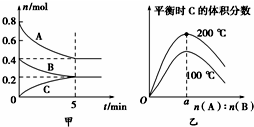 在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol?L-1?min-1 |
| B、200℃时,该反应的平衡常数为25 L2/mol2 |
| C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大 |
| D、由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.| 催化剂 |
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
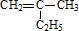 的键线式
的键线式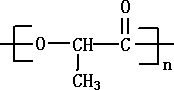 是由一种单体缩聚而成的,该单体的结构简式为
是由一种单体缩聚而成的,该单体的结构简式为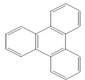 的一氯取代物有
的一氯取代物有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com