
【题目】下列物质中属于碱性氧化物的是( )
A.Na2OB.SO2C.NH3D.KOH
科目:高中化学 来源: 题型:
【题目】下表为元素周期表中前四周期的部分元素,表中所列的字母分别代表一种化学元素,根据要求回答下列各小题:
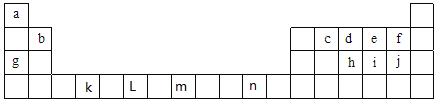
(1)①元素非金属性强弱比较有很多方法,其中f和j的非金属性强弱的研究方案中不可行的是_________(填序号)
a.比较两种单质的颜色 b.比较氢化物的稳定性 c.依据两元素在周期表的位置
d.比较电负性 e.比较最高价氧化物对应水合物的酸性
②根据元素原子的外围电子排布的特征,可将元素周期表前四周期元素分成4个区域,分别为s区、p区、d区、ds区,则属于s区的元素有_______种,属于d区的元素有_______种;元素n属于________区。
③在c、d、e三种元素中,电负性由小到大的顺序是______________,第一电离能由大到小的顺序是____________(用元素符号回答)。
(2)①写出 n2+的核外电子排布式:______________________。
②写出k元素基态原子的价电子排布式:_____________。
③写出 L元素基态原子的外围电子排布式:_____________。
④写出m元素基态原子价电子的轨道表示式:________________________,该元素在元素周期表中的位置为:__________________________。
⑤j简单阴离子的结构示意图为____________。
(3)①元素i的氢化物分子属于____________(填“极性”或“非极性”)分子,其分子的空间构型为____________,该氢化物分子中i原子轨道的杂化类型是__________; 由i与e形成的ie42-离子,其空间构型为__________(用文字描述)。
②已知cd- 与 d2 结构相似,1 mol cd- 中![]() 键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
键数目为___________,由d形成的离子d3-与CO2互为等电子体,则d3-的分子构型为___________。
③f2通入稀NaOH溶液中可生成Of2,Of2分子构型为___________,其中氧原子的杂化方式为_______;
④化合物j2e的立体构型为_________,中心原子的价层电子对数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )
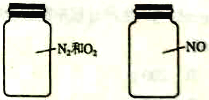
A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,等物质的量的乙烯和苯分别和足量氢气发生加成反应,消耗氢气的物质的量之比为( )。
A. 1∶1B. 1∶2C. 1∶3D. 1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列三种有机化合物:A.CH2=CH2 B.![]() C.CH3COOH
C.CH3COOH
(1)化合物C所含能电离出H+的原子团的名称是____________;
(2)三种化合物中能使溴的四氯化碳溶液褪色的是____________(填字母代号);
(3)写出在一定条件下,A发生聚合反应的化学方程式_______________
(4)写出在一定条件下,化合物C与CH3CH2OH发生反应的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚磷酸二乙酯[HPO(OC2H5)2]为重要的阻燃增塑剂。实验室采用三氯化磷和无水乙醇制备亚磷酸二乙酯PCl3 + 4C2H5OH → HPO(OC2H5)2 + HCl↑+2C2H5Cl + H2O;实验步骤如下:
①将40mL三氯甲烷和36.8g(0.8mol)无水乙醇混合后加入250mL三颈烧瓶中。
②从仪器A中滴加20mL三氯甲烷和27.5g (0.2mol)PCl3混合溶液,用冰水控温6~8℃,开动搅拌器,约1h滴加完毕。
③将反应物倒入烧杯中,用10%的碳酸钠溶液中和至pH为7~8,再用去离子水洗涤三次,在仪器B中分离。
④减压蒸馏,收集产品,得23.32g产品。
(1)装置图中仪器A叫做恒压滴液漏斗,与分液漏斗比,滴液时的优点是 ;步骤③中仪器B名称为 。图中NaOH溶液的作用为 。
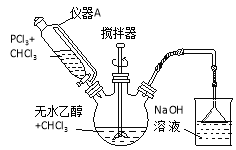
(2)用碳酸钠溶液洗涤的目的是 ;用去离子水洗涤的目的是 。
(3)减压蒸馏除得到产品外还可回收的有机物有 (写两个的结构简式)。
(4)从无水乙醇利用角度计算,本次实验产率为 (填数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一支试管里放入一小块铜片,注入一定体积的浓硫酸,再给试管加热,充分反应。
(1)写出反应的化学方程式_________________;若试管中铜片还有剩余,硫酸_________(填“已”或“未”)消耗完毕,其理由是 __________________________;
(2)若反应中有0.02molH2SO4被还原,则在标准状况下收集到的气体体积为__________mL,参加反应的铜的质量为____g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com