
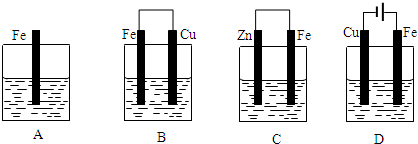
| 0.2mol |
| 2 |


科目:高中化学 来源: 题型:
| A、XW4为非极性分子 |
| B、Y、Z、W的最高价氧化物的水化物酸性强弱顺序是Y<Z<W |
| C、X、Y的氢化物由固态转化为气态时,克服相同的作用力 |
| D、XW4、YW4、ZW2分子中的中心原子均为sp杂化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
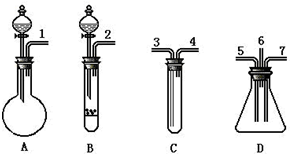 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | 部分特征 |
| A | 气态单质在标准状况下密度是0.0893g/L |
| B | 形成的化合物的种类最多 |
| C | 形成的氧化物的种类最多 |
| D | 形成的化合物焰色反应呈黄色 |
| E | 生活中常用的金属,在空气中表面通常形成一层致密的氧化膜 |
| F | 最高价氧化物对应的水化物酸性在短周期中最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
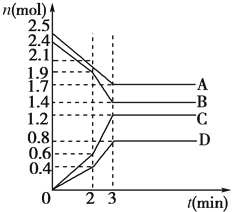 在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:
在某一容积为2L的密闭容器中,A、B、C、D四种气体物质的量(n)随时间(t)的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学反应速率与生产、生活密切相关.
化学反应速率与生产、生活密切相关.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 120 | 232 | 288 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
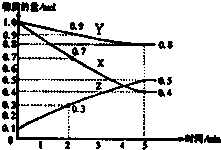
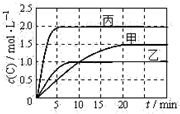 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以 | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5mol A 0.5mol B | 1.5mol A 0.5mol B | 6.0mol A 2.0mol B |
| A、10min内甲容器中反应的平均速率:v(A)=0.05mol?(L?min)-1 |
| B、由图可知T1>T2,且该反应为吸热反应 |
| C、x=1,若平衡时保持温度不变,改变容器体积平衡不移动 |
| D、T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com