
分析 根据溶液中阴阳离子所带电荷相等计算溶液中氢离子浓度,在根据pH的计算方法计算溶液的pH.
解答 解:溶液呈电中性,则溶液中阴阳离子所带电荷相等,所以c(Na+)+c(H+)+2c(Ca2+)=2c(SO42-)+c(Cl-)+c(NO3-),
即4×10-4mol/L+c(H+)+2×1.5×10-5 mol/L=2×2.5×10-4mol/L+1.6×10-5 mol/L+1.4×10-5 mol/L,
所以c(H+)=1×10-4mol/L,所以溶液的pH=4,
故答案为:4.
点评 本题考查了pH的简单计算,侧重考查学生的分析、计算能力,明确溶液中阴阳离子所带电荷相等是解本题的关键,然后根据pH的计算方法计算即可.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:实验题
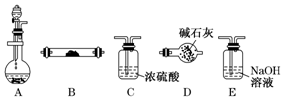 如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.
如图是用于气体制备、干燥、性质验证、尾气处理的部分仪器装置(加热及夹持固定装置均已略去).请根据下列要求回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四个共价单键 | B. | 一个双键,一个三键 | ||
| C. | 两个单键,一个双键 | D. | 一个单键,一个三键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 在常温常压下,46g NO2和N2O4混合气体所含氧原子数目为2NA | |
| C. | 将1L 2mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:填空题
(1)已知16克A和20克B恰好完全反应生成0.05mol C和30克D,则C的摩尔质量为_________(2)0.3mol氨气和0.4mol二氧化碳的质量___________(填“相等”或“不相等”,下 同),
同),
所含原子数____________。
(3)4 g H2与22.4 L(标准状况)CO2相比,所含分子数目较多的是____________。
(4)3.01×1023个CO2分子中含 mol氧原子,在标准状况下其体积为 L,它与 g H2O含有相同的氧原子数。
(5)写出下列物质的电离方程式:硫酸铵__________ ____;氢氧化钡_______ ___。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
同温同压下,A容器中HCl与B容器中NH3所含原子数相等,这两容器的体积之比为( )
A.1:4 B.4:1 C.1:2 D.2:1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
Na2CO3俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是
A.Na2CO3是碱 B.Na2CO3是盐 C.Na2CO3是钠盐 D.Na2CO3是碳酸盐
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
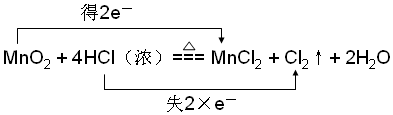 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com