
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
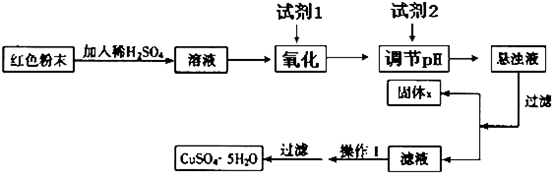


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 操作 | 预期现象 | 结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
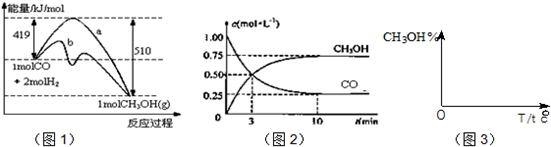
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、PM2.5值越大,形成雾霾天气的可能性越大 |
| B、PM2.5容易附着有毒有害物质,尤其是重金属,对人体造成危害 |
| C、城市由于汽车尾气的大量排放,比农村形成雾霾天气的可能性更大 |
| D、氟利昂作制冷剂会加剧雾霾天气的形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性 |
| B、SO2溶于水,其水溶液能导电,说明SO2是电解质 |
| C、用饱和Na2CO3溶液可将BaSO4转化为BaCO3,说明Ksp(BaSO4)>Ksp(BaCO3) |
| D、某溶液用盐酸酸化无明显现象,再滴加氯化钡溶液有白色沉淀产生,说明溶液中有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一部分为Al(OH)3,一部分为Al3+ |
| B、全部为Al(OH)3 |
| C、一部分为Al(OH)3,一部分为AlO2- |
| D、全部为AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 盐酸浸泡 |
| 过滤 |
| 氧化处理 |
| 足量的 |
| NaOH溶液 |
| 过滤 |
| 洗涤 |
| 煅烧 |
| A、Al |
| B、Al(OH)3 |
| C、Al3+ |
| D、[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com