
【题目】一定条件下,将SO2和O2充入一密闭容器中,发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
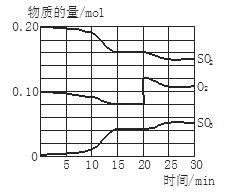
(1)降低温度,SO2的转化率_______,化学反应速度____ 。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是__ _______。
(3)反应进行至20 min时,曲线发生变化的原因是_____ _________________(用
文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
【答案】(1) 增大,减小。(2) (15—20)min、(25—30)min。(3) 增大了O2的浓度, a、b
【解析】(1)正反应是放热反应,所以降低温度,正逆反应速率均是减小的,平衡向正反应方向进行,所以平衡常数增大。
(2)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以根据图像可知,处于平衡状态的是15~20min,25~30min。
(3)反应进行至20 min时,氧气的浓度突然增大,而SO2的浓度逐渐减小,三氧化硫的浓度逐渐增大,所以改变的条件是增大氧气的浓度;根据图像可知,10 min到15 min时,物质的浓度变化量增大,即反应速率加快,所以改变的条件是使用了催化剂或改变了压强,答案选ab。


科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中充入气体A和B,发生如下可逆反应:A(g) +B(g)![]() xC(g);△H = Q。在不同的温度和压强下,C在反应混合物中的含量随反应时间的变化如图所示。下列判断正确的是
xC(g);△H = Q。在不同的温度和压强下,C在反应混合物中的含量随反应时间的变化如图所示。下列判断正确的是
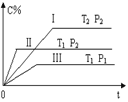
A. P1>P2,x=1 B. P1<P2,x≠1
C. T1<T2,Q>0 D. T1>T2,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。下图所示是硫及其部分化合物的“价类二维图”, 根据图示回答下列问题:

(1)图中A、B、C、D四种物质中,属于非电解质的是__________(用化学式表示)。
(2)足量B通入紫色石蕊溶液的现象是__________________________;
用一个化学方程式说明B具有还原性_____________________________。
(3)C在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,理论上其可被还原为__________(填标号)。
A.Na2S B.S C.H2SO3 D.Na2SO4 E.H2SO4
(4)将A与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为_____。
(5)D的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为_________________,反应中D显示酸性和______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学购买了一瓶“84消毒液”,包装说明如下。请根据说明信息和相关知识

(1)该“84消毒液”中,NaClO的物质的量浓度约为_______ mol/L(保留至小数点后一位)
(2)某化学课外活动小组计划使用NaOH溶液制取消毒液,反应原理为:Cl2+2NaOH=NaCl+ NaClO+H2O。制取时,需要多少升4.0mol/L的NaOH溶液才能与2.24L(标准状况下)的氯气恰好完全反应_________。(简要计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为V形的极性分子
B. ClO3-的空间构型为平面三角形
C. SF6中有6对完全相同的成键电子对
D. SiF4和SO32-的中心原子前者为sp3杂化,后者为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能够满足纯净物、电解质、单质的是( )
A.钢、氯化钠、金刚石B.铁、氨水、氯气
C.冰水混合物、氧化铁、氢气D.生理盐水、二氧化碳、糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的每一方格表示有关的一种反应物或生成物,其中甲、乙、丙、丁为常见单质,其余均为化合物。A是一种常见的液态化合物,B是具有磁性的氧化物,D和丁既能和酸反应又能和碱反应,乙在丙中燃烧产生苍白色火焰,H在空气中很容易被氧化成I。它们的转化关系如下:(有些反应的条件和部分产物未注明)

(1)写出下列物质化学式:B____________,F____________;
(2)写出反应①的化学方程式:________________________________________;
(3)H在空气中很容易被氧化成I,该过程的实验现象是_______________________________;
(4)将足量的CO2通入E溶液中,离子方程式是______________________________________。
(5)将G的饱和溶液滴入沸水中得红褐色液体,该液体具有的性质有_______。
A.具有丁达尔效应 B.红褐色液体可用过滤的方法提纯
C.液体中分散质微粒直径小于1nm D.取适量液体加入K2SO4溶液会产生红褐色沉淀 E. 它较稳定的存在,因其带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:
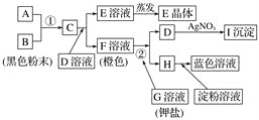
(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com