
【题目】过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量,请填写下列空白:
(1)移取10.00 mL密度为ρ g/mL的过氧化氢溶液至250mL (填仪器名称)中,加水衡释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数及化学式填写在方框里。
MnO4-+ H2O2+ H+= Mn2++ H2O+□
(3)滴定时,将高锰酸钾标准溶液注入 (填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是 。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为 。
(5)下列操作能使测定结果偏高的是
A.滴定前滴定管尖嘴中有气泡,滴定后气泡消失。
B.读取高锰酸钾标准溶液的刻度时,滴定前平视,滴定后俯视。
C.滴定前,在用蒸馏水洗涤滴定管后,未用高锰酸钾标准液润洗。
D.滴定过程中,锥形瓶中部分溶液溅出
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:
【题目】血液中的血红蛋白和肌肉中的蛋白质的结构不相同的原因 ( )
A. 所含氨基酸的种类不同
B. 所含氨基酸的数目不同
C. 所含氨基酸的排列顺序不同
D. 所含氨基酸的种类、数目、排列顺序和多肽空间结构都不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某K2CO3样品中含有Na2CO3、KNO3和Ba(NO3)2三种杂质中的一种或两种,现将6.9g样品溶于足量水中,得到澄清溶液,若再加入过量的CaCl2溶液,得到4.5g沉淀,对样品所含杂质的正确判断是( )
A.肯定有KNO3和Na2CO3 , 没有Ba(NO3)2
B.肯定有KNO3 , 没有Ba(NO3)2 , 可能还有Na2CO3
C.肯定没有Na2CO3和Ba(NO3)2 , 可能有KNO3
D.以上判断都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用标签所示浓盐酸配制250mL 0.4mol/L的稀盐酸,并进行有关实验. 
请回答:
(1)需要量取浓盐酸mL.
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有、 .
(3)若实验遇到下列情况,所配溶液的浓度会(填“偏高”、“偏低”、“不变”) A、定容时仰视刻度线;
B、容量瓶内壁附有水珠而未干燥处理;
C、溶解后没有冷却便进行定容 .
(4)将所配制的稀盐酸倒入5.92g Na2CO3和NaHCO3的固体混合物中,恰好完全反应,则原混合物中Na2CO3的质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度下,纯水的c(H+)=2×10- 7 mol·L-1,则此时c(OH-)为______;若温度不变,滴入稀盐酸使c(H+)=5×10- 4 mol·L-1则溶液中由水电离产生的c(H+)为______,此时温度______(填“高于”、“低于”或“等于”)25℃。
(2)已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+![]() O2(g)===H2O(g) ΔH2=-242.0 kJ/mol
O2(g)===H2O(g) ΔH2=-242.0 kJ/mol
③CO(g)+![]() O2(g)===CO2(g) ΔH3=-283. 0 kJ/mol
O2(g)===CO2(g) ΔH3=-283. 0 kJ/mol
写出C(s)与水蒸气反应生成CO和H2的热化学方程式:
_________________________________________________。
(3)常温下,取物质的量浓度相同的NaOH和HCl溶液,以3∶2体积比相混合,所得混合液的pH=12,则原溶液的物质的量浓度为______。(溶液体积变化忽略不计)
(4)常温下,0.l mol·L-1 H3PO4溶液的pH小于7,括号内离子浓度的大小顺序为(H2PO4- 、HPO42- 、PO43- 、OH- 和H +)___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验). 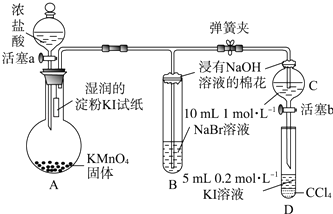
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸.
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹.
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a.
Ⅳ.…
(1)A中产生黄绿色气体,其电子式是 .
(2)验证氯气的氧化性强于碘的实验现象是 .
(3)B中溶液发生反应的离子方程式是 .
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 .
(5)过程Ⅲ实验的目的是 .
(6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下 , 得电子能力逐渐减弱.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量固体A加入恒容真空容器中发生可逆反应:2A(s)![]() 2B(g)+C (g),下列能说明反应已达平衡状态的是
2B(g)+C (g),下列能说明反应已达平衡状态的是
A. 混合气体的密度保持不变 B. 容器内B、C的浓度之比为2∶1
C. B的生成速率等于C的消耗速率 D. 气体的体积分数保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓硫酸的下列叙述中正确的是( )
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸在酯化反应中仅仅起催化作用
D. 浓硫酸在常温下能够使铁、铝等金属钝化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com