
【题目】若NA表示阿伏加德罗常数,下列说法正确的是
A. 2.3gNa在足量的氧气中充分燃烧,转移的电子数为0.2NA
B. 标准状况下,22.4 L水中含有的氧原子数为NA
C. 1L 0.5molL﹣1的AlCl3溶液中所含Cl数目为3NA
D. 0.1 mol 氯气所含有的原子数为0.2NA
【答案】D
【解析】
Na在足量的氧气中充分燃烧生成过氧化钠,钠元素化合价由0变为+1;标准状况下水是液体;1L 0.5molL﹣1的AlCl3溶液中含有AlCl3的物质的量是1L![]() 0.5molL﹣1=0.5mol;0.1 mol 氯气中含有0.2mol原子。
0.5molL﹣1=0.5mol;0.1 mol 氯气中含有0.2mol原子。
2.3gNa 的物质的量是0.1mol,Na在足量的氧气中充分燃烧生成过氧化钠,钠元素化合价由0变为+1,所以转移的电子数为0.1NA,故A错误;标准状况下水是液体,22.4 L水的物质的量不是1mol,故B错误;1L 0.5molL﹣1的AlCl3溶液中含有AlCl3的物质的量是1L![]() 0.5molL﹣1=0.5mol,所以Cl数目为1.5NA,故C错误;0.1 mol 氯气中含有0.2mol原子,所以原子数是0.2NA,故D正确。
0.5molL﹣1=0.5mol,所以Cl数目为1.5NA,故C错误;0.1 mol 氯气中含有0.2mol原子,所以原子数是0.2NA,故D正确。


科目:高中化学 来源: 题型:
【题目】H2Y2-是乙二胺四乙酸根(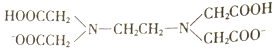 )的简写,可与多种金属离子形成络合物。
)的简写,可与多种金属离子形成络合物。
I. H2Y2-与Fe2+形成的络合物FeY2-可用于吸收烟气中的NO。其吸收原理:
FeY2-(aq)+NO(g)![]() FeY2-(NO)(aq) △H<0
FeY2-(NO)(aq) △H<0
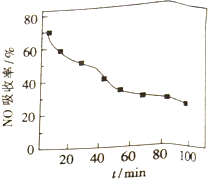
(1)将含NO的烟气以一定的流速通入起始温度为50℃的FeY2-溶液中。NO吸收率随通入烟气的时间变化如右图。时间越长,NO吸收率越低的原因是_________。
(2)生成的FeY2-(NO)(aq)可通过加入铁粉还原再生,其原理:FeY2-(NO)(aq)+Fe+H2O→FeY2-(aq)+Fe(OH)2+NH3(未配平)。
若吸收液再生消耗14g铁粉,则所吸收的烟气中含有NO的物质的量为_______。
II.络合铜(CuY2-)废水的处理一直是环境工程领域的研究热点。
(1)H2Y2-与Cu2+、Fe3+、Ca2+络合情况如下表:
络合反应 | lgK(K为平衡常数) |
Cu2++H2Y2- | 18.8 |
Fe3++H2Y2- | 25.1 |
Ca2++H2Y2- | 10.7 |
①表中最不稳定的金属络合物是_____(填化学式)。向含有络合铜(CuY2-)废水中加入一种黄色的盐溶液A可解离出Cu2+,则盐A中阳离子为________(填化学式)。
②调节pH可将解离出的Cu2+转化为Cu(OH)2沉淀,若要使c(Cu2+)≤2.2×10-4mol/L,pH应不低于________(常温下Ksp[Cu(OH)2]= 2.2×10-20)。
(2)羟基自由基(-OH)、Na2FeO2都可氧化络合铜中的Y4-而使Cu2+得到解离。
①酸性条件下,-OH可将Y4-(C10H12O8N24-)氧化生成CO2、H2O、N2。该反应的离子方程式为___________________。
②Na2FeO4在酸性条件下不稳定。用Na2FeO4处理后的废水中Cu2+的浓度与pH的关系如右图。pH越大,/span>废水处理效果越好,这是因为______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以苯酚为原料合成![]() 的路线如图所示.请按要求作答
的路线如图所示.请按要求作答

(1)写出鉴别苯酚与A这2种有机物的方法,用必要的文字说明: .
(2)写出以下物质的结构简式:B ,F .
(3)写出反应④的化学反应方程式:④ ,
(4)反应⑤可以得到E,同时可能得到的副产物的结构简式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已达到电离平衡的0.1 mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是( )
A. 加少量盐酸
B. 加热
C. 加少量醋酸钠晶体
D. 加少量NaOH晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,往水中不断加入NaHC2O4固体,部分微粒浓度随加入的c(HC2O4-)的变化趋势如下图所示。下列说法正确的是( )

A. 当c(HC2O4-)=0.1mol/L时,c(H+)>c(C2O42-)-c(H2C2O4)
B. 当c(HC2O4-)>amol/L时,c(H+)< c(H2C2O4),HC2O4-的水解程度大于电离程度
C. HC2O4-![]() C2O42-+H+,Ka(HC2O4-)=a
C2O42-+H+,Ka(HC2O4-)=a
D. 将0.08mo1/L H2C2O4溶液与等浓度NaOH溶液等体积混合后(忽略体积变化),c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如下实验装置制备少量的漂白粉。回答下列问题:
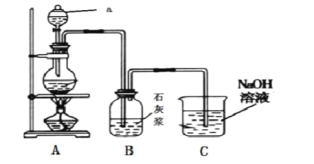
(1)漂白粉的有效成分是__________________(填化学式)。
(2)仪器a的名称是____________,用二氧化锰和浓盐酸制取氯气的化学方程式为MnO2 + 4HCl (浓)![]() MnCl2 + Cl2 ↑+ 2H2O 该反应中氧化剂与还原剂的物质的量之比为 ________________。
MnCl2 + Cl2 ↑+ 2H2O 该反应中氧化剂与还原剂的物质的量之比为 ________________。
(3)装置B发生反应的化学方程式为___________________________________。
(4)装置C的作用是___________,C中发生反应的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油裂解气用途广泛,可用于合成各种橡胶和医药中间体。利用石油裂解气合成CR橡胶和医药中间体K的线路如下:
已知: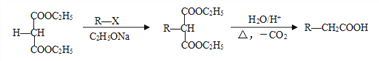
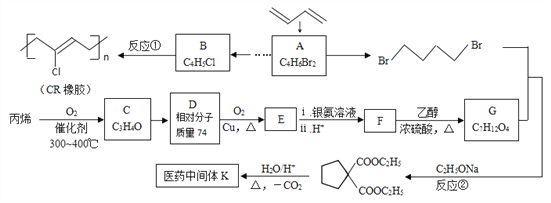
(1)A的反式异构体的结构简式为____________________ 。
(2)用系统命名法给B命名,其名称是__________________。
(3)依次写出①、②的反应类型、____________ 、____________。
(4)C、D、E均为链状结构,且均能与新制氢氧化铜悬浊液共热生成砖红色沉淀,则C中含有的官能团名称是________________________。 写出反应D→E的化学方程式_______________________________________________________。
(5)K的结构简式为_____________________________。
(6)写出F与乙二醇发生聚合反应的化学方程式___________________________________。
(7)写出同时满足下列条件的医药中间体K的所有同分异构体的结构简式_____________。
a.与E互为同系物 b.核磁共振氢谱有3种峰
(8)已知双键上的氢原子很难发生取代反应。以A为起始原料,选用必要的无机试剂合成B,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中含氧原子的物质的量一定相同的是
A. 3.36L O2 和 0.3 mol H2O
B. 0.1 mol H2SO4 和 3.6 g H2O
C. 0.1 mol FeSO4·7H2O 和 0.1 mol C12H22O11(蔗糖)
D. 6.02×1023 个 CO2 与 0.1 mol KMnO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
实验 | 现象 | 结论 | |
A | 向2mL0.1mol·L-1的FeCl3溶液中加足量铁粉,振荡,加1滴KSCN溶液 | 黄色逐期消失,加KSCN溶液颜色不变 | 还原性:Fe>Fe2+ |
B | 将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶 | 集气瓶中产生大量白烟,瓶内有黑色颗粒产生 | CO2具有氧化性 |
C | 加热盛有少NH4HCO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 石蕊试纸变蓝 | NH4HCO3显碱性 |
D | 向2支盛有2mL相同浓度银氨溶液的试管中分别加入2滴相同浓度的NaCl和NaI溶液 | 一只试管中产生黄色沉淀,另一支中无明显现象 | Ksp(AgI)<Ksp(AgCl) |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com