
 图是甲烷燃料电池的结构示意图.甲烷在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为 CH4+2O2→CO2+2H2O.下列说法不正确的是( )
图是甲烷燃料电池的结构示意图.甲烷在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为 CH4+2O2→CO2+2H2O.下列说法不正确的是( )| A. | 左电极为电池的负极,a处通入的物质是甲烷 | |
| B. | 电池工作时外电路电子从负极流向正极,内电路电子从正极流向负极 | |
| C. | 负极反应式为:CH4+2H2O-8e-→CO2+8H+ | |
| D. | 正极反应式为:O2+4H++4e-→2H2O |
分析 通过电子的移动方向知,a为负极,b为正极;燃料电池中,负极上投放燃料,燃料在负极上失电子发生氧化反应;正极上投放氧化剂,氧化剂在正极上得电子发生还原反应.
解答 解:A.通过电子的移动方向知,左电极为负极,右电极为正极,燃料电池中,负极上投放燃料,所以a处通入的物质是甲烷,故A正确;
B.电池工作时外电路电子从负极流向正极,内电路是离子作定向移动,不是电子,故B错误;
C.负极上投放的燃料,燃料甲烷失电子和水发生氧化反应生成二氧化碳和氢离子,电极反应式为CH4+2H2O-8e-═CO2+8H+,故C正确;
D.正极上投放的氧化剂,氧化剂得电子和氢离子反应生成水,正极反应式为:O2+4H++4e-═2H2O,故D正确;
故选B.
点评 本题以甲烷为燃料考查了燃料电池,难度不大,注意正负极上电极反应式的书写要结合电解质溶液的酸碱性,即使燃料和氧化剂相同,如果电解质溶液不同,电极反应式也不同.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 |
| A | FeCl2 | CuCl2 | 铁粉 |
| B | CO2 | HCl | 氢氧化钠溶液 |
| C | NaCl | Na2CO3 | 稀硫酸 |
| D | CuO粉 | Cu | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极,被还原 | B. | 正极,被氧化 | C. | 负极,被还原 | D. | 负极,被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-10mol•L-1 | B. | 1×10-8mol•L-1 | C. | 1×10-4mol•L-1 | D. | 1×10-6mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
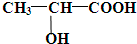
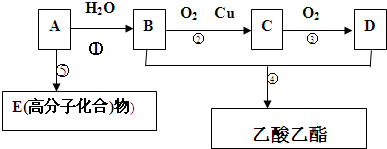
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 | |
| B. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
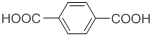 )的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?
)的混和物溶于100mL 1mol/L NaOH溶液中,然后用0.5mol/L H2SO4溶液滴定过量的NaOH,消耗硫酸溶液30mL.另取m g上述混和物溶于过量甲醇中,加入少量浓硫酸,加热使完全反应,分离、精制,得到酯的混和物,其质量比 m g增加15.8%,则m的数值为多少?查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com