
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。
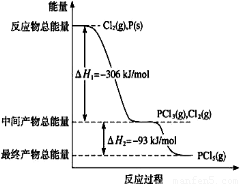
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是???????? ?????????????????????? ???? 。
②P和Cl2分两步反应生成1 mol PCl5的△H3=???? 。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
t / s | 0 | 50 | 150 | 250 | 350 |
n(PCl3) / mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
①反应在50~150s 内的平均速率v(PCl3)=???????????? 。
②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字)
(3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。
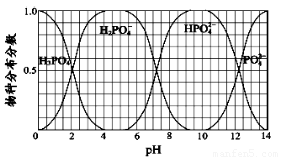
①为获得较纯的Na2HPO4,pH应控制在?????? ;pH=6时,溶液中主要含磷物种浓度大小关系为:??????? ????????????????????????????????????? ??? 。
②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析)???????????????????????????????????????????????????????? ?????? 。
(1)①PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol(2分,方程式1分,△H的表示1分,化学式、状态错误0分;+、焓变数值、单位错漏合扣1分;计量数用分数表示与焓变相匹配也给分)
②-399 kJ/mol(2分,单位错漏扣1分)?
(2)①1.5×10-4mol/(L·s) 或0.00015 mol/(L·s)(2分,单位错漏扣1分)
②2.5×10-2 mol/L或0.025mol/L
(3)①9~10.5(2分,介于此区间或区间内的某一点)
c(H2PO4-)>c(HPO42-) (2分)
②Na2HPO4溶液中存在电离平衡,HPO42- H++PO43-(1分),加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性(1分)。(合理即给分)
H++PO43-(1分),加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性(1分)。(合理即给分)
【解析】
试题分析:(1)①题干中特别注明图中物质转化的焓变是生成1mol产物的数据,因此PCl5分解成PCl3和Cl2是吸热反应,其热化学方程式为:PCl5(g)=PCl3(g)+Cl2(g) △H=+93kJ/mol;
②计算P和Cl2分两步反应生成1 mol PCl5 的焓变,根据盖斯定律反应的焓变与过程无关,只需将图像中两部分的焓变相加即可,所以△H3=-399 kJ/mol。
(2)①计算反应在50~150s 内的用PCl3表示的反应速率,只需把数据代入公式,因此有v(PCl3)=△C/△t=(0.19-0.16)mol/(2L×100s)= 1.5×10-4mol/(L·s);
②???????????????????? PCl5(g)? =?? PCl3(g)+Cl2(g)
起始浓度(mol/L)?? ? 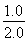 =0.50??? 0??????? 0
=0.50??? 0??????? 0
转化浓度(mol/L)? ?? 0.10??? 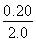 =0.10???? 0.10
=0.10???? 0.10
平衡浓度(mol/L)? ??? 0.40???? 0.10??? 0.10?????? (1分)
K= 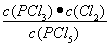 ? =?
? =? 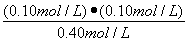 = 2.5×10-2 mol/L或0.025mol/L
= 2.5×10-2 mol/L或0.025mol/L
(3)此题要学会认真读图,该图表示的是H3PO4与不断加入的NaOH反应,氢氧化钠量不断增大使溶液pH值不断增大时,溶液中各含磷物种的百分比。每个含磷物种在一定的PH范围内都有百分含量极大和极小的情况,而两条线交叉部分表示的则是2种含磷物种同时存在的情况。
①要获得叫纯净的Na2HPO4,则通过图像找到PH值在9~10.5的范围内,HPO42- 的百分含量接近百分百,所以控制的PH只要在这个范围内,都可以获得较纯净的Na2HPO4 。
②Na2HPO4是弱酸酸式盐,HPO42-存在电离和水解两个平衡,由于溶液呈碱性,可以看出水解强于电离。但是该盐溶液加入氯化钙后,溶液呈酸性,因此可以推测加入的氯化钙一定改变了电离平衡,使之不断产生出氢离子,使溶液呈酸性。所以结合本题的题干“磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在”,可以解释平衡的移动为:Na2HPO4溶液中存在电离平衡,HPO42- H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性。
H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性。
考点:本题考查的是反应原理的知识,侧重于化学与反应能量的关系、反应速率和平衡常数计算、平衡移动原理解释等方面的考查。


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com