


科目:高中化学 来源: 题型:
| A、1:2 | B、1:4 |
| C、3:4 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该气体的相对分子质量是44 |
| B、该气体的体积是22.4L |
| C、该气体的质量是44G |
| D、该气体的原子数是3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2、SO2、CO都是酸性氧化物 |
| B、酒精、烧碱、冰醋酸都是电解质 |
| C、雾、稀豆浆、氯化铁溶液都是胶体 |
| D、氨水、空气、漂白粉都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
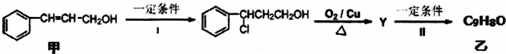
| Ⅰ.O3 |
| ⅡZn/H2O |
| Ⅰ.浓NaOH |
| Ⅱ.H+ |
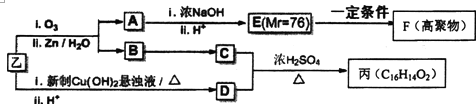
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:
CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂.利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离出来的c(H+)=10-12 mol?L-1的溶液中:Cl-、CO32-、K+、SO32- |
| B、含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| C、使甲基橙变红的溶液中:Fe2+、K+、NO3-、SO42- |
| D、使pH试纸变深蓝色的溶液中:Cl-、K+、Mg2+、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| n(H2O) |
| n(CO) |
| | =1 | =3 | =5 |
| 200 250 300 350 | 1.70 2.73 6.00 7.85 | 0.21 0.30 0.84 1.52 | 0.02 0.06 0.43 0.80 |
| n(H2O) |
| n(CO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com