
| A. | s区、d区、ds区都是金属元素 | |
| B. | p区都是主族元素 | |
| C. | 所有族中IIIB中元素种类最多 | |
| D. | 最外层电子数为2的元素都分布在s区 |
科目:高中化学 来源: 题型:选择题
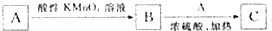 ,若A、B的碳骨架相同,则C的结构最多有
,若A、B的碳骨架相同,则C的结构最多有| A. | 4种 | B. | 5种 | C. | 6种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
高锰酸钾是一种重要的化学试剂,其溶液不是很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.| 滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
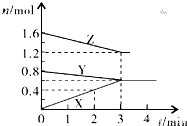 某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析
某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随间变化的曲线如图所示.由图中数据分析查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
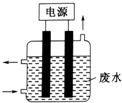 “8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题:
“8•12”天津港危化仓库爆炸,造成生命、财产的特大损失.据查危化仓库中存有大量的钠、钾,硝酸铵和氰化钠(NaCN).请回答下列问题: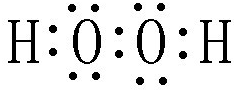 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体密度保持不变 | |
| B. | 单位时间内生成n mol A,同时生成3n mol B | |
| C. | 混合气体的压强保持不变 | |
| D. | C生成的速率与A分解的速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
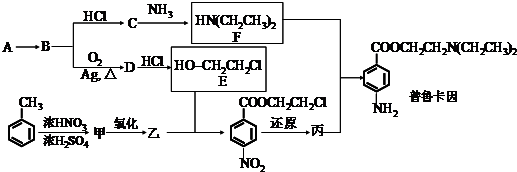
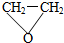 .
.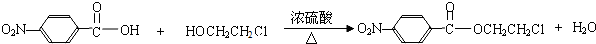 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com