
 ���ĺϳ�·�����£�
���ĺϳ�·�����£�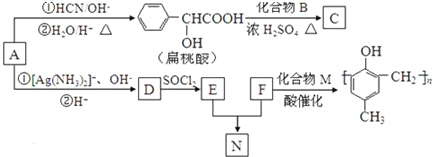
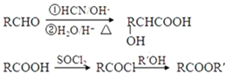 ��F����ʽΪC7H8O��
��F����ʽΪC7H8O��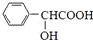 ���ж���ͬ���칹�壬������������������ͬ���칹����
���ж���ͬ���칹�壬������������������ͬ���칹���� ����AΪ
����AΪ ����2����A�����������ӳɷ�Ӧ����BΪ
����2����A�����������ӳɷ�Ӧ����BΪ ���������뱽�״�����������Ӧ����CΪ
���������뱽�״�����������Ӧ����CΪ ��A��������Һ����������Ӧ����DΪ
��A��������Һ����������Ӧ����DΪ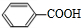 ��D������Ϣ�з�Ӧ����EΪ
��D������Ϣ�з�Ӧ����EΪ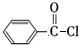 ��F����ʽΪC7H8O��F��M��Ӧ���ɸ߾���ɸ߾���Ľṹ��֪��FΪ
��F����ʽΪC7H8O��F��M��Ӧ���ɸ߾���ɸ߾���Ľṹ��֪��FΪ ��MΪHCHO��F��E����ȡ����Ӧ����GΪ
��MΪHCHO��F��E����ȡ����Ӧ����GΪ ���ݴ˽��
���ݴ˽��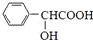 ����AΪ
����AΪ ����2����A�����������ӳɷ�Ӧ����BΪ
����2����A�����������ӳɷ�Ӧ����BΪ ���������뱽�״�����������Ӧ����CΪ
���������뱽�״�����������Ӧ����CΪ ��A��������Һ����������Ӧ����DΪ
��A��������Һ����������Ӧ����DΪ ��D������Ϣ�з�Ӧ����EΪ
��D������Ϣ�з�Ӧ����EΪ ��F����ʽΪC7H8O��F��M��Ӧ���ɸ߾���ɸ߾���Ľṹ��֪��FΪ
��F����ʽΪC7H8O��F��M��Ӧ���ɸ߾���ɸ߾���Ľṹ��֪��FΪ ��MΪHCHO��F��E����ȡ����Ӧ����GΪ
��MΪHCHO��F��E����ȡ����Ӧ����GΪ ��
�� �����й�����Ϊȩ�����ʴ�Ϊ��ȩ����
�����й�����Ϊȩ�����ʴ�Ϊ��ȩ���� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
�� ��
��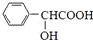 ���ж���ͬ���칹�壬��������������ˮ�⣬�������������ܷ���������Ӧ������ȩ��������FeCl3��Һ����ɫ�����з��ǻ���������Ϊ�����γɵ����������Ժ���2������Ϊ-OH��-CH2OOCH�����ڡ��䡢�����֣����Ժ���3������Ϊ-OH��-CH3��-OOCH����-OH��-CH3������λ��-OOCH��4��λ�ã���-OH��-CH3���ڼ�λ��-OOCH��4��λ�ã���-OH��-CH3���ڶ�λ��-OOCH��2��λ�ã��ʷ���������ͬ���칹���У�3+4+4+2=13�֣�����һ�����Ǽ���-CH2-����ͬ���칹��Ľṹ��ʽΪ��
���ж���ͬ���칹�壬��������������ˮ�⣬�������������ܷ���������Ӧ������ȩ��������FeCl3��Һ����ɫ�����з��ǻ���������Ϊ�����γɵ����������Ժ���2������Ϊ-OH��-CH2OOCH�����ڡ��䡢�����֣����Ժ���3������Ϊ-OH��-CH3��-OOCH����-OH��-CH3������λ��-OOCH��4��λ�ã���-OH��-CH3���ڼ�λ��-OOCH��4��λ�ã���-OH��-CH3���ڶ�λ��-OOCH��2��λ�ã��ʷ���������ͬ���칹���У�3+4+4+2=13�֣�����һ�����Ǽ���-CH2-����ͬ���칹��Ľṹ��ʽΪ��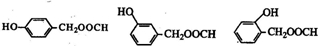 ��
�� ������һ�֣���
������һ�֣���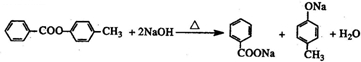 ��
��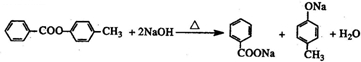 ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2 mol C |
| B��1 mol B��1 mol C |
| C��2 mol A��1 mol B |
| D��3 mol A��0.5 mol B |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��KCl |
| B��KCl��KI |
| C��KCl��KBr |
| D��KCl��KBr��I2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaOH��Һ��CH3COOH��Һ��������Ժ�c��CH3COO-��=c��Na+��=c��H+��=c��OH-�� |
| B��pH=3��CH3COOH��Һ��pH=11��KOH��Һ�������Ϻ�c��K+����c��CH3COO-����c��OH-����c��H+�� |
| C��pH=2��HNO3��Һ��pH=12��NH3?H2O��Һ�������Ϻ�c��NH4+����c��H+����c��OH-����c��NO3-�� |
| D��pH��ȵĢ�NH4Cl �ڣ�NH4��2SO4 ��NH4HSO4��Һ��c��NH4+����С˳��=�ڣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| cCO2?cH2 |
| cCO?cH2O |
| t/�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A������1 L���ܱ�������ͨ��CO2��H2��1 mol��5 min���¶����ߵ�830�棬��ʱ���CO2Ϊ0.4 molʱ���÷�Ӧ�ﵽƽ��״̬ | ||||
| B��������Ӧ������Ӧ�Ƿ��ȷ�Ӧ | ||||
| C���÷�Ӧ�Ļ�ѧ����ʽ��CO��g��+H2O��g��?CO2��g��+H2��g�� | ||||
D����ƽ��Ũ�ȷ������й�ϵʽ��
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CH3CH2CH2CH�TCH2 |
| B��CH2�TCH-CH2-CH�TCH2 |
C�� |
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
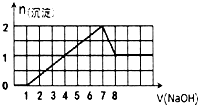 ij��Һ�п��ܺ���H+��Na+��Ba2+��Mg2+��Fe3+��Al3+��SO42-��CO32-�����ӣ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ����ͼ��ʾ�������ж���ȷ���ǣ�������
ij��Һ�п��ܺ���H+��Na+��Ba2+��Mg2+��Fe3+��Al3+��SO42-��CO32-�����ӣ��������Һ�м���һ�����ʵ���Ũ�ȵ�NaOH��Һʱ���������ɳ��������ʵ�����NaOH��Һ������仯��ͼ����ͼ��ʾ�������ж���ȷ���ǣ�������| A��ԭ��Һ��һ������H+��Fe3+��Al3+�����ܺ�Ba2+ |
| B��ԭ��Һ�к�Fe3+��Al3+�����ʵ���֮��Ϊl��l |
| C��ԭ��Һ�п��ܺ���CO32- |
| D����Ӧ����γɵ���Һ�к��е�����ֻ��NaAlO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��22.4 L CO��N2�Ļ������������ԭ������Ϊ2NA |
| B����֪2SO2��g��+O2��g��?2SO3��g����H=-a kJ?mol-1������2NA��SO2��NA��O2��ϳ�ַ�Ӧ�ų�a kJ������ |
| C��1 mol CO2�����й��ۼ�����Ϊ2NA |
| D��25��ʱ��pH=13��1.0 L Ba��OH��2��Һ�к��е�OH-��ĿΪ0.1NA |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com