
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列实验。

请回答:
(1)虚线框处宜选择的装置是___(填“甲”或“乙”);实验时应将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是___。
(2)硬质玻璃管中铁和水蒸气反应的化学方程式为___(并用单线桥表示电子转移情况)。取硬质玻璃管中适量的固体,用一定浓度的盐酸溶解,滴加KSCN溶液,没有出现血红色,说明该固体中没有+3价的铁,判断结论是否正确并用文字和离子方程式说明理由___。
【答案】乙 铜丝由黑变红 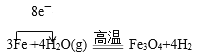 不正确,因为铁过量时:2Fe3++Fe=3Fe2+
不正确,因为铁过量时:2Fe3++Fe=3Fe2+
【解析】
本实验的目的是探究铁、铜及其化合物的性质,其中图中的装置是探究Fe和水蒸气的反应,该反应的产物是Fe3O4和H2;虚线中的装置是CuO和H2反应的场所;根据上述分析答题即可。
(1)图示装置中发生的反应为3Fe+4H2O(g)![]() Fe3O4+4H2,经干燥后H2进入到虚线中的装置,由于该装置中还要发生H2和CuO的反应,故该装置的另外一个作用是收集H2,由于H2的密度比空气小,所以应选用装置乙;将变黑后的铜丝深入到乙中,发生反应H2+CuO
Fe3O4+4H2,经干燥后H2进入到虚线中的装置,由于该装置中还要发生H2和CuO的反应,故该装置的另外一个作用是收集H2,由于H2的密度比空气小,所以应选用装置乙;将变黑后的铜丝深入到乙中,发生反应H2+CuO![]() Cu+H2O,故可看到铜丝由黑变红;
Cu+H2O,故可看到铜丝由黑变红;
(2)硬质玻璃管中的化学反应为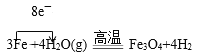 ;用稀盐酸溶解反应后的固体,原本应该有Fe3+,但是加入KSCN后,溶液不变红,说明Fe3+被反应掉了,则最可能的原因是Fe粉过量,和Fe3+发生反应:Fe+2Fe3+=3Fe2+,故题中的结论不正确。
;用稀盐酸溶解反应后的固体,原本应该有Fe3+,但是加入KSCN后,溶液不变红,说明Fe3+被反应掉了,则最可能的原因是Fe粉过量,和Fe3+发生反应:Fe+2Fe3+=3Fe2+,故题中的结论不正确。


科目:高中化学 来源: 题型:
【题目】常温下,向10.00 mL 0.1mol/L某二元酸H2X溶液中逐滴加入0.1 mol/L NaOH溶液,其pH变化如图所示(忽略温度变化),已知:常温下,H2X的电离常数Ka1=1.1×10-5,Ka2=1.3×10-8。下列叙述正确的是
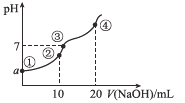
A.a近似等于3
B.点②处c(Na+)+2c(H+)+c(H2X)=2c(X2-)+c(HX-)+2c(OH-)
C.点③处为H2X和NaOH中和反应的滴定终点
D.点④处c(Na+)=2c(X2-)>c(OH-)>c(HX-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可由![]() 、
、![]() 、
、![]() 为原料制备
为原料制备![]() ,若反应后废液中的
,若反应后废液中的![]() 排入水中,则过量的氮元素会使水体富营养化。此外考虑到其他污染源,污水一般还会含有
排入水中,则过量的氮元素会使水体富营养化。此外考虑到其他污染源,污水一般还会含有![]() 、
、![]() 、
、![]() 等。
等。
(1)已知![]() 化学式可表示为
化学式可表示为![]() ,由常温下逐渐升温的过程中会发生分解。已知起始状态到A点是失去了部分结晶水,B点对应的物质是钒的氧化物,如下图所示。
,由常温下逐渐升温的过程中会发生分解。已知起始状态到A点是失去了部分结晶水,B点对应的物质是钒的氧化物,如下图所示。
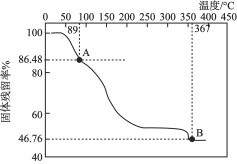
①写出起始状态到A点发生分解反应的化学方程式:________________。
②B点对应物质的化学式是______________。
(2)废水中![]() 和
和![]() 的处理。通过形成铁炭(铁和活性炭)原电池可对废水中的有机物及含氮物质等进行处理,将酸性废水中以
的处理。通过形成铁炭(铁和活性炭)原电池可对废水中的有机物及含氮物质等进行处理,将酸性废水中以![]() 和
和![]() 形式存在的氮元素转化为
形式存在的氮元素转化为![]() 除去。
除去。
①写出![]() 在正极发生的电极反应式______________。
在正极发生的电极反应式______________。
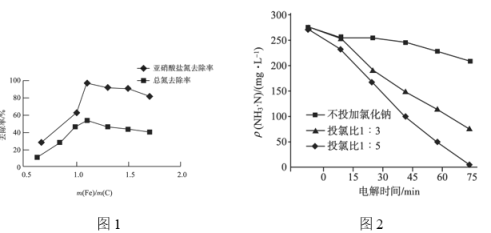
②不同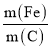 的脱氮效果如图1所示,则合适的
的脱氮效果如图1所示,则合适的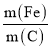 =________。
=________。
③实验测得当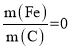 时,对废水中的氮也有一定的脱除率,其原因为________。
时,对废水中的氮也有一定的脱除率,其原因为________。
(3)废水中![]() 的处理。用电解法可对废水进行脱氮处理。
的处理。用电解法可对废水进行脱氮处理。
①电解时含氯离子转化为次氯酸,![]() 与
与![]() 反应生成
反应生成![]() ,当生成
,当生成![]() 时,转移的电子数为________mol。
时,转移的电子数为________mol。
②氯离子含量对废水脱氮效果的影响如图2所示,投氯比是指氨氮与氯离子物质的量的比,三种情况下投料为![]() 时脱氮效果________(填“最好”“最差”或“居中”),原因可能是________。
时脱氮效果________(填“最好”“最差”或“居中”),原因可能是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有168g NaHCO3 固体,加热到质量不再变化为止,试计算:
(1)剩余固体的质量(m);__________
(2) (标准状况下)产生气体的体积v。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁[Fe(OH)SO4]n能用作净水剂(絮凝剂),可由绿矾(FeSO4·7H2O)和KClO3在水溶液中反应得到。下列说法不正确的是( )
A.KClO3作氧化剂,每生成1mol [Fe(OH)SO4]n消耗![]() mol KClO3
mol KClO3
B.绿矾长时间置于空气中易被氧化
C.聚合硫酸铁可在水中形成氢氧化铁胶体而净水
D.聚合硫酸铁与漂白粉都是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芘经氧化后可用于染料合成。芘的一种转化路线如图所示,下列叙述正确的是
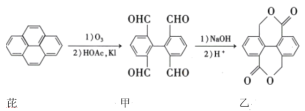
A.芘的一氯代物有4种
B.甲分子中所有碳原子一定都在同一平面上
C.lmol乙与足量NaOH溶液反应,最多消耗2molNaOH
D.甲催化氧化后,再发生酯化反应也能得到乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象能得到相应结论的是
选项 | 实验操作和现象 | 结 论 |
A | 向苯酚钠溶液中通入足量CO2溶液变浑浊 | 酸性:H2CO3>C6H5OH>HCO3- |
B | 向KBrO3溶液中通入少量Cl2然后再加入少量苯,有机层呈橙红色 | 氧化性:Cl2>Br2 |
C | 将等浓度等体积的KI溶液和FeCl3溶液混合,充分反应后滴入KSCN溶液,溶液变红 | 溶液中存在平衡: 2Fe3++2I- |
D | 向2支均盛有2mL相同浓度银氨溶液的试管中,分别滴入2滴相同浓度的KCl、KI溶液,前者无明显现象,后者有黄色沉淀 | Ksp(Agl)>Ksp(AgCl) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料出现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其它稀土原料。
(1)钕(Nd)为60号元素,在元素周期表中的位置是___;
(2)实验测得气态A1C13的实际存在形式为A12C16双聚分子,其中A1原子的杂化方式是___;A12C16与过量NaOH溶液反应生成Na[Al(OH)4];[A1(OH)4]-中存在的化学键有___。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
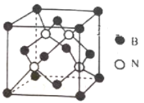
(3)已知立方BN晶体晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为b gcm-3,则阿伏加德罗常数为____mol-1 (列式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.5molCH4和1.2molNO2充入体积为1L的密闭容器中,发生反应: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是
A.T1时0~10minNO2的平均反应速率为0.15mol·L-1·min-1
B.T2时CH4的平衡转化率为70.0%
C.保持其他条件不变,T1时向平衡体系中再充入0.3molCH4和0.80molH2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.5molCH4和1.2molNO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com