
| ĆܶČ/£Øg•cm-3£© | ČŪµć/”ę | ·Šµć/”ę | |
| ĖÄĀČ»ÆĪż | 2.2 | -33 | 114 |
| ½šŹōĪż | 5.77 | 231 |
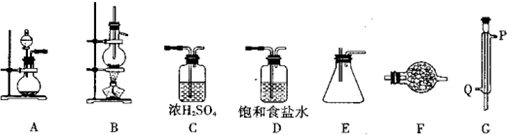
·ÖĪö £Ø1£©°“ÕÕĘųĢåµÄ·¢Éś”¢³żŌÓ”¢øÉŌļ”¢Ī²ĘųĪüŹÕµČÉč¼ĘŹµŃéŅĒĘ÷µÄĮ¬½Ó£»
£Ø2£©GĪŖĄäÄż¹Ü£¬Ó¦“ÓQ½ųĖ®£¬“ÓP³öĖ®£»
£Ø3£©AÖŠÖʱøĀČĘų£¬ŌŚ²»¼ÓČȵÄĢõ¼žĻĀ½ųŠŠ£¬Ó¦ÓĆøßĆĢĖį¼ŲŗĶÅØŃĪĖįÖʱø£»
£Ø4£©FÖŠŹ¢×°¼īŹÆ»Ņ£¬¾ßÓŠ¼īŠŌ£¬æÉÓėĖ®»ņĖįŠŌĘųĢå·“Ó¦£»SnCl4Ė®½āÉś³ÉĒāŃõ»ÆĪżŗĶĀČ»ÆĒā£»
£Ø5£©øł¾Ż·½³ĢŹ½Sn+2Cl2=SnCl4æÉÖŖ£¬4.8gSnĶźČ«·“Ó¦ĄķĀŪÉĻÉś³ÉSnCl4µÄÖŹĮæĪŖ$\frac{261}{119}”Į4.8g$=10.53g£¬øł¾ŻSnCl4µÄ²śĀŹ=$\frac{Źµ¼Ź²śĮæ}{ĄķĀŪ²śĮæ}$”Į100%¼ĘĖć£®
½ā“š ½ā£ŗ£Ø1£©ÓĆAÖʱøĀČĘų£¬·Ö±šŌŚD”¢CÖŠ½ųŠŠ³żŌÓŗĶøÉŌļ£¬Č»ŗóŌŚBÖŠ·¢Éś·“Ó¦ÖʱøSnCl4£¬ĄäČ“ŗóŌŚEÖŠŹÕ¼Æ£¬×īŗóĮ¬½ÓF£¬½ųŠŠĪ²ĘųĪüŹÕ£¬Į¬½ÓĖ³ŠņĪŖD”śC”śB”śG”śE”śF£¬
¹Ź“š°øĪŖ£ŗD”śC”śB”śG”śE”śF£»
£Ø2£©GĪŖĄäÄż¹Ü£¬ĪŖ“ļµ½³ä·ÖĄäÄżµÄŠ§¹ū£¬Ó¦“ÓQ½ųĖ®£¬“ÓP³öĖ®£¬
¹Ź“š°øĪŖ£ŗĄäÄż¹Ü£»Q£»
£Ø3£©AÖŠÖʱøĀČĘų£¬ŌŚ²»¼ÓČȵÄĢõ¼žĻĀ½ųŠŠ£¬Ó¦ÓĆøßĆĢĖį¼ŲŗĶÅØŃĪĖįÖʱø£¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ2MnO4-+16H++10Cl-=2Mn2++5Cl2”ü+8H2O£¬
¹Ź“š°øĪŖ£ŗ2MnO4-+16H++10Cl-=2Mn2++5Cl2”ü+8H2O£»
£Ø4£©FÖŠŹ¢×°¼īŹÆ»Ņ£¬¾ßÓŠ¼īŠŌ£¬æÉÓėĖ®»ņĖįŠŌĘųĢå·“Ó¦£¬·ĄÖ¹æÕĘųÖŠµÄĖ®·Ö½ųČė×°ÖĆEÖŠ£¬ĪüŹÕ¶ąÓąµÄCl2·ĄÖ¹ĪŪČ¾£¬SnCl4Ė®½āÉś³ÉĒāŃõ»ÆĪżŗĶĀČ»ÆĒā£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖSnCl4+4H2O=Sn£ØOH£©4+4HCl£¬
¹Ź“š°øĪŖ£ŗ¼īŹÆ»Ņ£»·ĄÖ¹æÕĘųÖŠµÄĖ®·Ö½ųČė×°ÖĆEÖŠ£¬ĪüŹÕ¶ąÓąµÄCl2·ĄÖ¹ĪŪČ¾£»SnCl4+4H2O=Sn£ØOH£©4+4HCl£»
£Ø5£©øł¾Ż·½³ĢŹ½Sn+2Cl2=SnCl4æÉÖŖ£¬4.8gSnĶźČ«·“Ó¦ĄķĀŪÉĻÉś³ÉSnCl4µÄÖŹĮæĪŖ$\frac{261}{119}”Į4.8g$=10.5g£¬SnCl4µÄ²śĀŹ=$\frac{Źµ¼Ź²śĮæ}{ĄķĀŪ²śĮæ}$”Į100%=$\frac{9.4g}{10.5g}$”Į100%=90%£¬
¹Ź“š°øĪŖ£ŗ90%£®
µćĘĄ ±¾Ģāæ¼²éÖʱøŹµŃé·½°øµÄÉč¼Ę£¬ĢāÄæÄѶČÖŠµČ£¬±¾Ģā×¢ŅāÖʱøĀČĘųµÄ·“Ó¦Ģõ¼ž£¬²»¼ÓČČŹ±ÓĆøßĆĢĖį¼ŲŗĶÅØŃĪĖį·“Ó¦£¬½ā“šŹ±×¢ŅāĢāÖŠŠÅĻ¢£®


 ĆūŠ£ĶØŠŠÖ¤ÓŠŠ§×÷ŅµĻµĮŠ“š°ø
ĆūŠ£ĶØŠŠÖ¤ÓŠŠ§×÷ŅµĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ē°Õß“ó | B£® | ŗóÕß“ó | C£® | ĻąµČ | D£® | ĪŽ·ØČ·¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| ČŻĘ÷ | ĪĀ¶Č/K | ĘšŹ¼ĪļÖŹµÄĮæ/mol | Ę½ŗāĪļÖŹµÄĮæ/mol | Ę½ŗā³£Źż | |
| CO2 | H2S | H2O | |||
| ¢ń | 607 | 0.1 | 0.15 | 0.05 | - |
| ¢ņ | 607 | 0.2 | 0.3 | - | |
| ¢ó | 627 | 0.1 | 0.15 | - | 6”Į10-2 |
| A£® | øĆ·“Ó¦ĪŖĪüČČ·“Ó¦ | |
| B£® | 607KŹ±£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ0.50 | |
| C£® | ČŻĘ÷¢ņ“ļµ½Ę½ŗāŹ±£¬ČŻĘ÷ÖŠCOSµÄĪļÖŹµÄĮæÅضČĪŖ0.025 mol£®L-1 | |
| D£® | ČŻĘ÷¢ó“ļµ½Ę½ŗāŹ±£¬ŌŁ³äČėÉŁĮæŗ¤Ęų£¬Ę½ŗā½«ĻņÕż·“Ó¦·½ĻņŅĘ¶Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | CH3OHµÄČ¼ÉÕČČĪŖ192.9kJ/mol | |
| B£® | ÓÉÉĻŹöŌĄķæÉĶĘÖŖH2µÄČ¼ÉÕČČĪŖ241.9 kJ/mol | |
| C£® | ·“Ó¦¢ŚÖŠµÄÄÜĮæ±ä»ÆæÉÓĆĶ¼±ķŹ¾£ŗ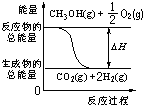 | |
| D£® | CH3OH×Ŗ±ä³ÉH2µÄ¹ż³ĢŅ»¶ØŅŖĪüŹÕÄÜĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē³Ų·ÅµēŹ±Na+“Ób¼«ĒųŅĘĻņa¼«Ēų | |
| B£® | µē¼«b²ÉÓĆMnO2£¬MnO2¼Č×÷µē¼«²ÄĮĻÓÖÓŠ“ß»Æ×÷ÓĆ | |
| C£® | ĆæĻūŗÄ1 mol H2O2£¬×ŖŅʵĵē×ÓĪŖ1 mol | |
| D£® | øƵē³ŲµÄÕż¼«·“Ó¦ĪŖBH4-+8OH--8e-ØTBO2-+6H2O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | c£ØNH4+£©£¾c£ØCl-£©£¬c£ØOH-£©£¾c£ØH+£© | B£® | c£ØCl-£©£¾c£ØNH4+£©£¬c£ØOH-£©£¾c£ØH+£© | ||
| C£® | c£ØCl-£©£¾c£ØNH4+£©£¬c£ØH+£©£¾c£ØOH-£© | D£® | c£ØNH4+£©=c£ØCl-£©£¬c£ØOH-£©=c£ØH+£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 °¢Ė¾Ę„ĮÖæŚ·žŹ±£¬¾ßÓŠ½āČČÕņĶ“×÷ÓĆ£¬ŹĒŅ»ÖÖ³£ÓƵÄÖĪĮĘøŠĆ°µÄŅ©Īļ£¬Ņ²æÉÓĆÓŚæ¹·ēŹŖ£¬“Ł½ųĶ“·ē»¼ÕßÄņĖįµÄÅÅŠ¹£®½üÄźĄ“»¹·¢ĻÖ°¢Ė¾Ę„ĮÖÄÜŅÖÖĘŃŖŠ”°åÄż¾Ū£¬æÉ·ĄÖ¹ŃŖĖصÄÉś³É£»ĖüµÄÓŠŠ§³É·ÖŹĒŅŅõ£Ė®ŃīĖį£Ø
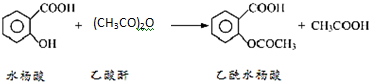
°¢Ė¾Ę„ĮÖæŚ·žŹ±£¬¾ßÓŠ½āČČÕņĶ“×÷ÓĆ£¬ŹĒŅ»ÖÖ³£ÓƵÄÖĪĮĘøŠĆ°µÄŅ©Īļ£¬Ņ²æÉÓĆÓŚæ¹·ēŹŖ£¬“Ł½ųĶ“·ē»¼ÕßÄņĖįµÄÅÅŠ¹£®½üÄźĄ“»¹·¢ĻÖ°¢Ė¾Ę„ĮÖÄÜŅÖÖĘŃŖŠ”°åÄż¾Ū£¬æÉ·ĄÖ¹ŃŖĖصÄÉś³É£»ĖüµÄÓŠŠ§³É·ÖŹĒŅŅõ£Ė®ŃīĖį£Ø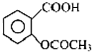 £©£®
£©£®
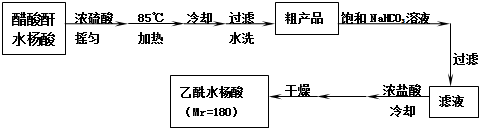
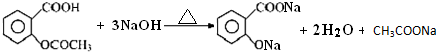
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com