
【题目】无水CuCl2为棕黄色固体,用于颜料、木材防腐等工业,并用作消毒剂、媒染剂、催化剂等。实验室用如图所示装置制取CuCl2。(夹持装置省略)
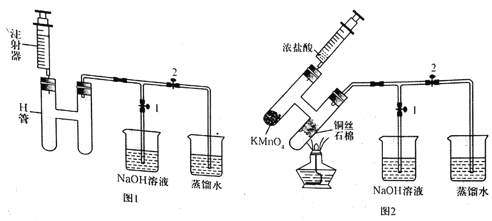
步骤1:制备时,首先按照图1所示连接实验装置。打开两处的止水夹,检验装置的气密性。
步骤2:用镊子向H管一端装入少量石棉,将其置于H管连通管以下部分且靠近连通管约![]() 处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
处,将卷成团状的细铜丝置于石棉上。H管的另外一端装入少量KMnO4固体。在注射器中装入少量浓盐酸,待用。
步骤3:关闭止水夹2,打开止水夹1,将H管如图2所示倾斜放置,点燃酒精灯,加热铜丝直至其呈红热状态。立即将浓盐酸注入H管使其与KMnO4发生反应(注意调整H管倾斜度以利于浓盐酸的加入),观察到有黄绿色气体通过连通管部分进入H管另一端,继而与热铜丝燃烧得到产物。
待反应结束后,等待一段时间再打开止水夹2,关闭止水夹1,拉动注射器将蒸馏水慢慢的吸入H管中,在H管底部得到CuCl2溶液。最后进行尾气的处理操作。请回答以下有关问题。
(1)检验图1所示装置气密性时的操作方法是______。反应过程中将H管倾斜放置的目的是_________(写出一条即可)。
(2)浓盐酸与KMnO4反应的化学方程式为______。热铜丝燃烧得到产物时,铜丝上方的H管中观察到的现象是_____。反应结束后,“等待一段时间”再进行后续操作的原因是______。
(3)实验观察到蒸馏水慢慢地吸入H管中时,H管底部得到CuCl2溶液的颜色,有一个从黄绿色到绿色再到蓝绿色的变化过程。已知在溶液中[Cu(H2O)4]2+呈蓝色,[CuCl4]2-呈黄色。请用方程式表示溶液颜色变化的化学平衡体系:___。
(4)H管中铜丝不直接放置在右管底部的优点是___(写出两条即可)。
【答案】慢慢向上拉动注射器 便于用酒精灯加热(或有利于氯气与铜丝的接触等) 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 有棕黄色的烟产生 防止蒸馏水使热的H管炸裂 [CuCl4]2-+4H2O![]() [Cu(H2O)4]2++4Cl- 有利于氯气与铜丝接触②有利于观察溶液的形成过程③防止(或减少)反应过程中H管炸裂等
[Cu(H2O)4]2++4Cl- 有利于氯气与铜丝接触②有利于观察溶液的形成过程③防止(或减少)反应过程中H管炸裂等
【解析】
(1)根据压强对气体体积的影响分析;Cu与Cl2反应在加热条件下进行;
(2)浓盐酸具有还原性,KMnO4具有氧化性,二者混合发生氧化还原反应,产生KCl、MnCl2、Cl2、H2O,据此书写反应的化学方程式,结合CuCl2是棕黄色固体分析实验现象;玻璃导热性差,放置一段时间,H管温度降低,进入水,就可以避免H管炸裂;
(3)根据不同微粒的颜色的不同,结合平衡移动分析判断;
(4)从反应物接触面积大小、观察溶液颜色变化、实验安全等角度分析判断。
(1)检查装置气密性的方法是慢慢向上拉动注射器,使装置中气体压强减小,外界大气压大于装置内气体压强,水、NaOH溶液会沿导气管进入装置,形成一段稳定的水柱,从而证明装置气密性良好;
KMnO4与浓盐酸混合反应产生Cl2,Cl2与Cu在加热时反应产生CuCl2,Cu丝放在石棉绒上,将H管倾斜,就可以增大H管中Cu的受热面积,便于用酒精灯加热(或有利于氯气与铜丝的接触等);
(2)浓盐酸具有还原性,KMnO4具有氧化性,二者混合发生氧化还原反应,产生KCl、MnCl2、Cl2、H2O,根据电子守恒、原子守恒,可得该反应的化学方程式为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;Cu与Cl2加热反应产生CuCl2,使H管上部空间产生棕黄色的烟;该反应在加热条件下进行,反应放出热量,使H管内气体温度很高,反应结束后,“等待一段时间”待容器冷却后再拉动注射器将蒸馏水慢慢的吸入H管中,在H管底部得到CuCl2溶液。就可防止蒸馏水使热的H管炸裂;
(3)H管底部得到CuCl2溶液的颜色,有一个从黄绿色到绿色再到蓝绿色的变化过程。这是由于在溶液中[CuCl4]2-呈黄色,[Cu(H2O)4]2+呈蓝色,在刚开始时溶液中[CuCl4]2-浓度较大,溶液显黄色,随着水的加入,溶液中水含量增多,发生反应:[CuCl4]2-+4H2O![]() [Cu(H2O)4]2++4Cl-,使[CuCl4]2-浓度减小,而[Cu(H2O)4]2+浓度逐渐增大,因此溶液颜色从黄绿色到绿色再到蓝绿色的变化过程;
[Cu(H2O)4]2++4Cl-,使[CuCl4]2-浓度减小,而[Cu(H2O)4]2+浓度逐渐增大,因此溶液颜色从黄绿色到绿色再到蓝绿色的变化过程;
(4)在进行该实验时,H管中铜丝不直接放置在右管底部而是放在石棉绒上,可以使H管中Cu丝底部有一定的空间,就有利于氯气与铜丝接触,使反应速率加快;同时可防止(或减少)反应过程中反应放出热,由于Cu丝直接接触容器导致H管炸裂;也有利于观察溶液的形成过程及溶液的颜色变化等。


科目:高中化学 来源: 题型:
【题目】用KI溶液和FeCl3溶液进行如下实验。下列说法中错误的是 ( )

A.实验i发生的反应为:2Fe3++2I-2Fe2++I2
B.黄色溶液中含有Fe2+、Fe3+、Cl-、K+、I-离子
C.实验ⅲ水溶液中c(Fe2+)小于ⅰ中c(Fe2+)
D.若向实验ⅲ所得液体中滴加![]() 溶液,水层红色比实验ⅱ浅
溶液,水层红色比实验ⅱ浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:Al2O3(s)+3C(s)=2Al(s)+3CO(g) ΔH1=+1 344.1 kJ·mol-1,2AlCl3(g)=2Al(s)+3Cl2(g) ΔH2=+1 169.2 kJ·mol-1,由Al2O3、C和Cl2反应生成AlCl3的热化学方程式为______________。
(2)贮氢合金ThNi5可催化由CO、H2合成CH4 的反应。已知温度为T时:CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH=+165 kJ·mol-1,CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-41 kJ·mol-1,温度为T时,该反应的热化学方程式为__________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。已知25 ℃,101 kPa时:4Fe(s)+3O2(g)=2Fe2O3(s) ΔH=-1 648 kJ·mol-1,C(s)+O2(g)=CO2(g) ΔH=-393 kJ·mol-1 2Fe(s)+2C(s)+3O2(g)=2FeCO3(s) ΔH=-1 480 kJ·mol-1,FeCO3在空气中加热反应生成Fe2O3的热化学方程式是______。
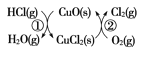
(4)用O2将HCl转化为Cl2,可提高效益,减少污染。 传统上该转化通过如图所示的催化循环实现,其中,反应①为:2HCl(g)+CuO(s)![]() H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
H2O(g)+CuCl2(s) ΔH1,反应②生成1 mol Cl2(g)的反应热为ΔH2,则总反应的热化学方程式为________(反应热用ΔH1和ΔH2表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子![]() 、
、![]() 、
、![]() 、
、![]() 都具有相同的电子层结构,则下列叙述正的是
都具有相同的电子层结构,则下列叙述正的是
A.原子半径A>B>D>CB.原子序数d>c>b>a
C.离子半径C>D>B>AD.单质的还原性A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“星型”聚合物具有独特的结构,在新兴技术领域有广泛的应用。下图是某“星型”聚合物的制备过程。
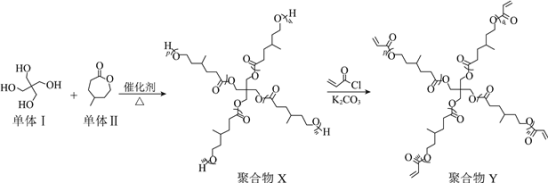
已知:![]()
下列说法不正确的是
A.单体Ⅰ的核磁共振氢谱有两组吸收峰,峰面积比为1∶2
B.单体Ⅰ与单体Ⅱ制备聚合物X,产物中有H2O
C.聚合物X转化为聚合物Y发生取代反应
D.聚合物Y可通过末端的碳碳双键交联形成网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种重要的有机产品,其合成路线如下:
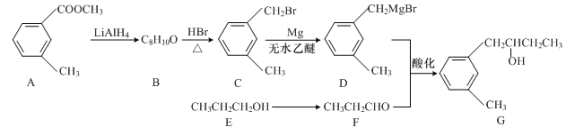
(1)E→F的反应还需的反应物和反应条件为_____。
(2)B的结构简式是_____。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式:_______。
①分子中有4种不同化学环境的氢;
②能发生银镜反应和水解反应,且1mol该物质最多能与2mol NaOH反应。
(4)写出以![]() 和CH3CHO为原料,制备
和CH3CHO为原料,制备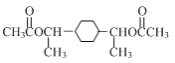 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。_____
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com