
| A. | 488.3 kJ/mol | B. | -224.15 kJ/mol | C. | -488.3 kJ/mol | D. | 244.15 kJ/mol |
分析 由盖斯定律可知2×②+③×2-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),则△H=2△H2+2△H3-△H1,带入数据进行计算.
解答 解:已知①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3KJ/mol,
②C(s)+O2(g)=CO2(g)△H2=-393.5KJ/mol,
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=-285.8kJ•mol-1,
将方程式2×②+③×2-①得:2C(s)+2H2(g)+O2(g)=CH3COOH(l),
则△H=2△H2+2△H3-△H1=2(-393.5kJ/mol)+(-571.6KJ/mol)-(-870.3KJ/mol)=-488.3kJ/mol,
故选C.
点评 本题考查了用盖斯定律进行有关反应热的计算,题目难度中等,明确盖斯定律的含义为解答关键,注意掌握盖斯定律在热化学方程式的计算中的应用方法,试题培养了学生的分析能力及化学计算能力.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2在反应中既作氧化剂又作还原剂 | |
| B. | O2是氧化产物 | |
| C. | Na2FeO4既是氧化产物又是还原产物 | |
| D. | 2molFeSO4发生反应时,共有12mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N×10-2 mol/L | B. | $\frac{N}{1.204×1{0}^{22}}$ mol/L | ||
| C. | $\frac{N}{6.02×1{0}^{21}}$mol/L | D. | $\frac{N}{6.02×1{0}^{25}}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铜是一种新型化合物 | |
| B. | 纳米铜颗粒比普通铜具有更强的化学活性 | |
| C. | 纳米铜粒子大小介于1~100 nm | |
| D. | 利用丁达尔现象可区别纳米铜和普通铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子所以能导电 | |
| B. | 二氧化硫的水溶液能导电,所以二氧化硫是电解质 | |
| C. | 硫酸钡难溶于水,但硫酸钡属于电解质 | |
| D. | 液态氯化氢不导电,所以氯化氢是非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
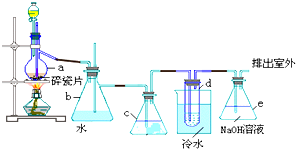
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com