
| A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
分析 A、苯酚具有弱酸性,能和碱反应生成盐和水;
B、苯也能发生取代反应;
C、苯、甲烷不能被酸性KMnO4溶液氧化,甲苯能被酸性KMnO4溶液氧化为苯甲酸,据此解答即可;
D、苯也能与氢气发生加成反应.
解答 解:A、苯酚能和NaOH溶液反应,说明苯酚具有弱酸性,能和碱反应生成盐和水,不能说明苯环对侧链性质有影响,故A错误;
B、苯也能发生取代反应,故甲苯与液溴,铁作催化剂的反应不能说明侧链对苯环性质有影响,故B错误;
C、甲苯可看作是CH4中的1个H原子被-C6H5取代,苯、甲烷不能被酸性KMnO4溶液氧化使其褪色,甲苯能被酸性KMnO4溶液氧化为苯甲酸,苯环未变化,侧链甲基被氧化为羧基,说明苯环影响甲基的性质,故C正确;
D、苯、甲苯都能能与H2发生加成反应,是苯环体现的性质,不能说明苯环对侧链性质产生影响,故D错误,故选C.
点评 本题考查学生苯酚的化学性质,关键是要从侧链对苯环性质的影响以及苯环对侧链性质的影响来理解把握,较简单.


科目:高中化学 来源: 题型:选择题
| A. | 光导纤维、合成纤维和人造纤维都是有机高分子化合物 | |
| B. | 合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 | |
| C. | H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
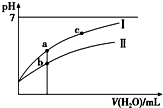 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( ) | CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
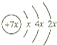 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分离、提纯→确定分子式→确定实验式→确定结构式 | |
| B. | 分离、提纯→确定实验式→确定分子式→确定结构式 | |
| C. | 分离、提纯→确定结构式→确定实验式→确定分子式 | |
| D. | 确定分子式→确定实验式→确定结构式→分离、提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①③④ | C. | ②④⑥ | D. | 只有⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 操作II中,通入硫化氢至饱和的目的是使Sn2+转化为SnS沉淀并防止Fe2+被氧化 | |
| B. | 在溶液中用硫酸酸化至pH=2的目的防止Fe2+沉淀 | |
| C. | 操作Ⅰ所得滤液中可能含有Fe3+ | |
| D. | 常用标准KMnO4溶液滴定的方法测定绿矾产品中Fe2+的含量,滴定时发生反应的离子方程式为:5Fe2++MnO4-+8H+→5Fe3++Mn2++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 无色溶液中滴加氯水和CCl4,振荡、静置 | 上层溶液显紫色 | 原溶液中有I- |
| B | 将SO2通入酸性KMnO4溶液中 | 紫色褪去 | SO2具有还原性 |
| C | 向明矾溶液中通入过量氨气 | 先产生大量白色沉淀,后沉淀逐渐消失 | Al(OH)3能溶于氨水 |
| D | AgI沉淀中滴入浓KCl溶液 | 有白色沉淀出现 | 溶解度:AgCl<AgI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com