
 ,氯化铵中存在铵根离子与氯离子形成的离子键,铵根离子中还存在极性共价键,
,氯化铵中存在铵根离子与氯离子形成的离子键,铵根离子中还存在极性共价键,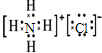 ;离子键、极性共价键;
;离子键、极性共价键;| 8 |
| 3 |
| 8 |
| 3 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、3:4:3 |
| B、1:2:3 |
| C、1:1:1 |
| D、2:3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
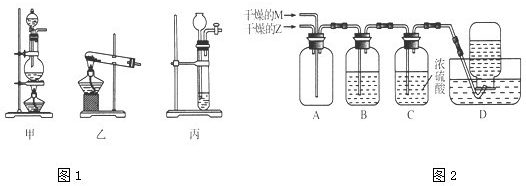
 为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.
为了证明铜与稀硝酸反应产生一氧化氮,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
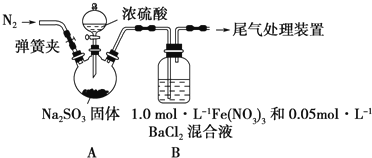
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容. 你认为该同学的错误步骤有
你认为该同学的错误步骤有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧燃料电池的负极反应:O2+2H2O+4e-═4OH- |
| B、惰性材料做电极电解饱和食盐水时,阳极的电极反应为:2Cl--2e-═Cl2↑ |
| C、粗铜精炼时,与电源正极相连的是纯铜,电极反应为:Cu-2e-═Cu2+ |
| D、钢铁发生电化学腐蚀的正极反应:Fe-2e-═Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com