
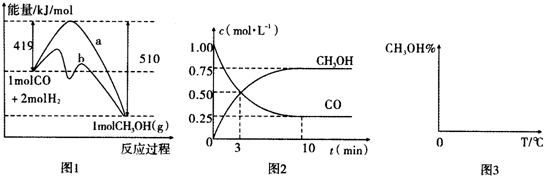
分析 (1)根据图中反应的活化能的大小来分析是否使用催化剂,利用反应前后的总能量来分析反应的能量变化;
(2)CO(g)+2H2(g)?CH3OH(g).
A.根据n=cV计算;
B.增加CO浓度,H2的转化率增大;
C.反应前后压强不变,说明气体的物质的量不变;
D.增大压强平衡正向移动;
(3)根据CO的浓度变化求出氢气的浓度变化,再根据v=$\frac{△c}{t}$;利用各物质平衡的浓度来计算化学平衡常数;若保持0.5其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5molCH3OH,根据Qc与k的相对大小判断;
(4)根据温度和压强对该反应的影响来分析;
(5)32g的CH3OH的物质的量为1mol,结合盖斯定律计算.
解答 解:(1)加入催化剂,可降低反应的活化能,由图象可知b活化能较低,应加入催化剂;反应物的总能量大于生成物的总能量,所以该反应属于放热反应;
故答案为:b;放热;
(2)CO(g)+2H2(g)?CH3OH(g).
A.体积为2L,起始时CO的浓度为1mol/L,则n=cV=2mol,即起始充入的CO为2mol,故A错误;
B.增加CO浓度,H2的转化率增大,CO的转化率会减小,故B错误;
C.该反应前后计量数不相同,反应前后压强不变,说明气体的物质的量不变,所以反应已达平衡状态,故C正确;
D.该反应为气体物质的量减小的反应,增大压强平衡正向移动,则甲醇的物质的量增大,CO的物质的量减小,所以平衡时$\frac{n(C{H}_{3}OH)}{n(CO)}$会增大;
故答案为:AB;
(3)从反应开始到建立平衡,平衡时:c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,则消耗n(CO)=0.75mol/L×2L=1.5mol,消耗的n(H2)=3mol,
平衡时c(H2)=$\frac{4mol-3mol}{2L}$=0.5mol/L,v(H2)=$\frac{\frac{3mol}{2L}}{10min}$=0.15mol/(L•min);
k=$\frac{0.75}{0.25×0.{5}^{2}}$=12;
若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5molCH3OH,此时容器中各物质的浓度为c(CO)=0.5mol/L,c(CH3OH)=1.5mol/L,c(H2)=1mol/L,Qc=$\frac{1.5}{0.5×{1}^{2}}$=3<k,反应未达到平衡状态,所以反应向正反应方向进行;
故答案为:0.15mol/(L•min);12;正反应方向;
(4)增大压强,平衡向正反应方向移动,则甲醇的百分含量增大,温度升高,平衡向逆反应方向移动,甲醇的百分含量降低,则图象可为,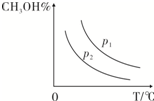
故答案为: ;
;
(5)①CH3OH(g)+$\frac{3}{2}$O2=CO2(g)+2H2O(g)△H=-192.9KJ/mol,②H2O(l)=H2O(g)△=44KJ/mol,
利用盖斯定律将①-②×2可得CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O
△H=(-192.9kJ/mol)-44KJ/mol×2=-280.9kJ/mol,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-280.9kJ/mol.
点评 本题考查了热化学方程式书写方法与盖斯定律的计算、化学平衡的影响因素分析判断、平衡常数计算应用等,题目涉及的知识点较多,掌握基础是解题关键,题目难度中等,侧重于考查学生的分析能力和计算能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 当混合气体的平均摩尔质量不再发生变化时,说明反应达到平衡状态 | |
| B. | 用X表示5 min内此反应的反应速率是(0.1-0.2a)mol•(L•min)-1 | |
| C. | 向平衡后的体系中加入l mol M,v(逆)增大,v(正)减小,平衡逆向移动 | |
| D. | 若平衡后再充入l mol X和(n+1)mol Y,再次达平衡时X的物质的量大于(2-2a)mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH-CH=CH21,3-二丁烯 | B. | CH3COOCH2CH2OOCCH3乙二酸二乙酯 | ||
| C. | 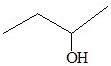 3-丁醇 3-丁醇 | D. | 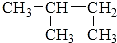 2-甲基丁烷 2-甲基丁烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
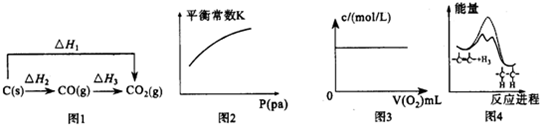 ( )
( )| A. | 图1中的△H1>△H2 | |
| B. | 对于可逆反应A(s)+3B(g)?2C(g)△H>0,压强对平衡常数K的影响符合图2 | |
| C. | 图3表示充满NO2气体的试管,倒置于水槽中,向其中缓慢通入氧气直至试管中全部充满水,假设溶质不扩散,溶质的物质的量浓度与通入氧气的体积关系 | |
| D. | 由图4可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
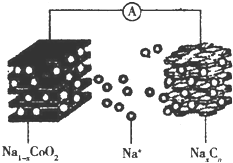 “摇椅型”钠离子电池充放电原理为NaCoO2+Cn$?_{充电}^{放电}$Na1-xCoO2+NaxCn,电池结构如图所示.下列说法正确的是( )
“摇椅型”钠离子电池充放电原理为NaCoO2+Cn$?_{充电}^{放电}$Na1-xCoO2+NaxCn,电池结构如图所示.下列说法正确的是( )| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,钴的化合价升高 | |
| C. | 充电时,阴极的质量减小 | |
| D. | 充电时,阳极的电极反应式为NaCoO2-xe-═Na1-xCoO2+xNa+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 环境要求 | 离子 |
| A | 溶液中c(K+)<c(Cl-) | K+、AlO2-、Cl-、NO3- |
| B | NaHCO3溶液 | K+、ClO-、AlO2- |
| C | 水电离产生的c(H+)=10-12 mol/L-1的溶液 | ClO-、CO32-、NH4+、NO3-、SO32- |
| D | 逐滴滴加氨水立即有沉淀产生 | Na+、HCO3-、Mg2+、SO42- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl- | |
| B. | 水电离的c(H+)=10-12 mol•L-1的溶液:K+、Ba2+、NH4+、Br- | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol•L-1的溶液:Na+、K+、SiO32-、NO3- | |
| D. | 1.0 mol•L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
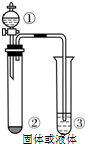 仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )
仅用下表右边的装置和表中提供的相应容器中的物质完成相关实验,最合理的选项是( )| 选项 | ① | ② | ③ | 实验目的或结论 |
| A | 浓氨水 | 生石灰 | 水 | 制取氨气并吸收尾气 |
| B | 浓盐酸 | 二氧化锰 | 淀粉碘化钾溶液 | 氧化性:MnO2>Cl2>I2 |
| C | 浓磷酸 | 氢溴酸溶液 | AgCl的浊液 | 验证Ksp(AgCl)>Ksp(AgBr) |
| D | 浓硫酸 | 亚硫酸钠 | 高锰酸钾溶液 | 验证二氧化硫的漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com