研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:2NO
2(g)+NaCl(s)?NaNO
3(s)+ClNO(g)K
1Q>0(Ⅰ)2NO(g)+Cl
2(g)?2ClNO(g)K
2Q>0(Ⅱ)
(1)由(Ⅰ)(Ⅱ)得到:4NO
2(g)+2NaCl(s)?2NaNO
3(s)+2NO(g)+Cl
2(g)式子,请写出平衡常数表达式K=
.
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向 2L恒容密闭容器中加入0.2mol NO和0.1mol Cl
2,10min时反应(Ⅱ)达到平衡.测得10min内V(ClNO)=7.5×10
-3mol?L
-1?min
-1,则平衡后n(Cl
2)=
mol,NO的转化率а
1=
.30.其它条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率а
2
а
1(填“>”“<”或“=”),平衡常数K
2
(填“增大”“减小”或“不变”).
(3)若要使K
2减小,可采用的措施是
.
(4)实验室可用NaOH溶液吸收 NO
2,反应为2NO
2+2NaOH→NaNO
3+NaNO
2+H
2O.含0.2mol NaOH的水溶液与0.2mol NO
2恰好完全反应得 1L溶液A,溶液B为0.1mol?L
?1的CH
3COONa溶液,则两溶液中c(NO
3?)、c(NO
2?)和c(CH
3COO?)由大到小的顺序为
.(已知HNO
2的电离常数Ki=7.1×10
-4mol?L
?1,CH
3COOH的电离常数K i=1.7×10
-5mol?L?
1).
(5)可使溶液A和溶液B的pH相等的方法是
.
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d..向溶液B中加适量NaOH.



 高中必刷题系列答案
高中必刷题系列答案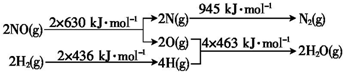 H2还原NO生成氮气和水蒸气的热化学方程式是
H2还原NO生成氮气和水蒸气的热化学方程式是